
Anmerkungen zur Transkription befinden sich am Ende dieses Textes.

Otto Wigand, Verlagsbuchhandlung m. b. H., Leipzig
HANDWÖRTERBUCH
DER DEUTSCHEN SPRACHE
von Dr. Daniel Sanders
Neu bearbeitet, ergänzt u. vermehrt
von Dr. Ernst Wülfing
Achte (der Neubearbeitung erste) Auflage
Geheftet Mark 8.—, gebunden Mark 10.—
Der „Kleine Sanders‟, der bekannte von Sanders selbst besorgte Auszug aus seinem großen vierbändigen „Wörterbuch‟, der seit seinem ersten Erscheinen vor gerade 40 Jahren sieben Auflagen erlebt hat und in rund 40000 Abdrucken verkauft worden ist, liegt in neuer, reich ergänzter und vermehrter Bearbeitung und in ganz neuem Gewande vor uns. Vor der alten Ausgabe zeichnet sich die neue schon rein äußerlich durch die vornehme Ausstattung und die größere Breite der Spalten aus; vor allem aber ist, wenn auch im ganzen die Druckanordnung der alten Ausgabe beibehalten wurde, doch in zahlreichen Einzelheiten alles getan worden, um dem Buch eine bei weitem größere Übersichtlichkeit zu verschaffen. — Der Bearbeiter Dr. E. Wülfing, hat das Buch mit besonderer Sorgfalt durchgesehen, es besonders, wo alte Lücken waren, aus dem „Großen Sanders‟ ergänzt und es anderseits durch zahlreiche neue Wörter vermehrt, die die verflossenen 40 Jahre, namentlich auf dem Gebiete der Technik aufgebracht haben. Auch wurde an manchen Stellen die bessernde Hand angelegt, wo das nach den Fortschritten der Sprachwissenschaft nötig erschien, besonders bei so mancher Bedeutungsentwicklung, die von Sanders s. Z. nicht richtig erkannt und aufgestellt wurde oder werden konnte. An Reichhaltigkeit, besonders auf dem Gebiete der neuesten technischen Ausdrücke und u. a. auch der Pflanzennamen, übertrifft der „Sanders-Wülfing‟, wie der „Kleine Sanders‟ wohl jetzt genannt werden wird, alle vorhandenen kleineren deutschen Wörterbücher. Besonders sei noch erwähnt, daß Wülfing an zahllosen Stellen dafür gesorgt hat, daß durch Einfügung von kurzen Belegen und Anführungen aus dem Schrifttum, sowie von knappen Beispielen die Erläuterungen, die ohne solche oft nicht ganz klar waren, belebt worden sind. Daß endlich die neue Rechtschreibung eingeführt worden ist, braucht nicht besonders betont zu werden.
Ein unentbehrliches Hand- und Nachschlagebuch für jeden Gebildeten
Von
Prof. Dr. W. Bermbach.
Zweite, vermehrte und verbesserte Auflage
Mit 38 Abbildungen.

Otto Wigand
Verlagsbuchhandlung und Buchdruckerei m. b. H.
Leipzig 1911.
Die Literatur über Akkumulatoren ist zwar eine ziemlich reichhaltige, jedoch fehlt es an einem nicht zu umfangreichen Buche, in dem sowohl die Theorie wie die Praxis, letztere, soweit sie größere Kreise interessiert, genügend berücksichtigt wird. Dieses dürfte in dem vorliegenden Werkchen geschehen sein.
Wenn irgendwo, so gilt für den Bleiakkumulator der Satz: Eine gute Theorie ist die beste Praxis. Denn hier gibt uns die Theorie Aufschluß über alle im Betriebe vorkommenden Erscheinungen. Aus diesem Grunde wurde die Theorie des Bleiakkumulators ausführlich behandelt. Damit sich nun auch solche Leser, denen die Grundbegriffe der modernen Elektrochemie nicht geläufig sind, zurechtfinden können, habe ich in dem ersten Kapitel die neueren Ansichten über die Elektrolyse und die Stromerzeugung in galvanischen Elementen gemeinverständlich behandelt.
Cöln, Mai 1905.
Die meisten Kapitel wurden neu bearbeitet, die beiden letzten Kapitel außerdem nicht unwesentlich erweitert. Über den Edison-Akkumulator liegt jetzt genügend Material vor; dementsprechend wurde er in der neuen Auflage ausführlicher behandelt.
Herrn Dr. H. Geisler spreche ich für seine Unterstützung bei dem Lesen der Korrekturbogen meinen verbindlichsten Dank aus.
Cöln, Juni 1911.
Der Verfasser.
| Seite | |
| 1. Kapitel. Theorie der Elektrolyse und der galvanischen Elemente | 1 |
| 2. Kapitel. Theorie des Bleiakkumulators | 34 |
| 3. Kapitel. Kapazität, Wirkungsgrad, Nutzeffekt, innerer Widerstand | 60 |
| 4. Kapitel. Ladung und Entladung | 80 |
| 5. Kapitel. Vorgänge im ruhenden Akkumulator | 105 |
| 6. Kapitel. Plattenkonstruktionen, Herstellung der Platten, Formation | 116 |
| 7. Kapitel. Aufstellung der Batterie, Einbau der Platten, Vorschriften über die Behandlung, Lebensdauer | 132 |
| 8. Kapitel. Der alkalische Akkumulator | 152 |
| 9. Kapitel. Die Verwendung der Akkumulatoren | 166 |
[1]
Vorläufige Erklärung der Vorgänge im Bleiakkumulator. Ein Bleiakkumulator in seiner einfachsten Gestalt besteht aus zwei Bleiplatten, die in verdünnte Schwefelsäure eintauchen. Schickt man durch den elektrolytischen Apparat einen elektrischen Strom, so bildet sich an derjenigen Elektrode, die mit dem positiven Pole der Stromquelle verbunden ist, der Anode, Bleisuperoxyd, das eine braunrote Farbe hat; an der negativen Elektrode, der Kathode, wird Bleioxyd[1], das sich, bevor die Bleiplatten in die Säure getaucht wurden, an der Luft gebildet hatte, zu metallischem Blei reduziert.
Wenn an beiden Elektroden Gasentwicklung erfolgt — was bei unserem Laboratoriumsversuch schon nach kurzer Zeit der Fall ist —, so unterbricht man den Ladestrom. Wir haben jetzt die Kombination vor uns Blei und Bleisuperoxyd in verdünnter Schwefelsäure:
| Pb | H2SO4 + aqua | PbO2 |
| - | + |
Das Minuszeichen unter Blei bedeutet, daß die betreffende Platte der negative Pol des Elementes ist.[2] Unsere Kombination ist, wie wir leicht mittels eines Galvanoskops nachweisen können, ein galvanisches Element, ähnlich wie
| Zn | H2SO4 + aq | Cu. |
| - | + |
Wie wir später sehen werden, bildet sich bei der Entladung auf beiden Elektroden Bleisulfat. Die beiden Platten werden also einander um so ähnlicher, je mehr Elektrizität unser Akkumulator abgibt. Wenn man aber zwei gleiche Elektroden in denselben Elektrolyten eintaucht, so erhält man kein galvanisches Element. Die elektromotorische Kraft unseres primitiven Akkumulators muß also während der Stromabgabe mehr oder weniger schnell abnehmen.
Bei dem beschriebenen Laboratoriumsversuch findet man, daß nach Beendigung der Entladung die braunrote Farbe keineswegs ganz verschwunden ist, daß also Reste von PbO2 zurückbleiben.
Laden wir den Akkumulator jetzt wieder, so wird Bleisulfat an der negativen Elektrode in metallisches Blei und an der positiven Platte in Bleisuperoxyd verwandelt.
Bei der Ladung sowohl wie bei der Entladung spielen sich im Akkumulator chemische Prozesse ab. Bei der Ladung wird ein chemisches System gleichsam gewaltsam verändert (ähnlich wie eine Spiralfeder beim Zusammendrücken), das veränderte System hat das Bestreben, in seinen ursprünglichen Zustand zurückzukehren. Bei der Ladung wird in dem Akkumulator chemische Energie aufgespeichert, und zwar entsteht diese aus elektrischer Energie. In dem Akkumulator wird also keineswegs elektrische Energie als solche aufbewahrt, gerade so wenig wie dies bei einem Gewichte der Fall ist, das durch einen Elektromotor gehoben wurde. Den[3] Charakter eines galvanischen Elementes erhält der Akkumulator erst dadurch, daß man ihm elektrische Energie zuführt. Man bezeichnet ihn daher auch als Sekundärelement.
Im Prinzip unterscheidet sich ein geladener Akkumulator in nichts von einem gewöhnlichen Primärelement (z. B. einem Daniell-Element). Wir müssen daher im Folgenden auf die Theorie der galvanischen Elemente näher eingehen.
An den chemischen Vorgängen im Akkumulator ist der Elektrolyt in hervorragender Weise beteiligt. Es ist daher jedem, der nur etwas tiefer in die Theorie des Bleiakkumulators eindringen will, anzuraten, sich ein möglichst klares und vollständiges Bild von den Vorgängen, die sich bei der Elektrolyse der verdünnten Schwefelsäure abspielen, zu verschaffen. [Hingewiesen sei hier auf das Kapitel VIII in Le Blancs Lehrbuch der Elektrochemie.]
Da die neueren elektrochemischen Theorien, soweit es der Raum gestattet, in unserer Schrift Berücksichtigung finden sollen, so wollen wir mit einer Besprechung einiger wichtiger Grundbegriffe dieses Gebietes beginnen.
Der osmotische Druck. Um diesen außerordentlich wichtigen Begriff klar zu machen, wollen wir von einem Nichtelektrolyten ausgehen; als Beispiel diene eine Zuckerlösung. Ein Standglas mit vorspringendem Rande fülle man mit einer Zuckerlösung und verschließe das Glas mittels einer vorher in lauwarmem Wasser aufgeweichten Schweinsblase, wobei darauf zu achten ist, daß keine Luftblasen eingeschlossen werden. Durch einen Bindfaden ist die Membran unterhalb des Glasrandes gut zu befestigen. Stellt man das Präparat in ein größeres, mit Wasser gefülltes Gefäß, so findet man nach etwa 24 Stunden, daß sich die Membran sehr[4] stark gewölbt hat, und wir schließen daraus, daß von der Zuckerlösung auf die Membran ein Druck ausgeübt wurde. Da die Wölbung nicht erfolgt, wenn wir das Standglas mit Wasser füllen, so schließen wir weiter, daß der eben erwähnte Druck von den Zuckermolekülen herrührt. — Die Schweinsblase hat die Eigenschaft[2], den Wassermolekülen den Durchgang zu gestatten, nicht aber den Zuckermolekülen, sie ist halbdurchlässig oder semipermeabel. Denken wir uns nun die Zeit in sehr kleine Intervalle geteilt, so können wir die Vorgänge in dem Standglase (Zelle) folgendermaßen erklären: Die Zuckermoleküle üben einen Druck auf die Membran aus; diese wird um ein unendlich kleines Stück gehoben, in den freien Raum dringt Wasser ein. Während des folgenden Zeitabschnittes wiederholt sich das Spiel usw. Die Membran wölbt sich also langsam im Laufe der Zeit. Dem osmotischen Drucke der Zuckermoleküle — so nennt man den auf die Membran ausgeübten Druck — wirkt die Spannung der Membran entgegen. Nehmen wir nun an, daß die Schweinsblase vollkommen, auch bei jedem Drucke halbdurchlässig ist, und daß sie jeden beliebig hohen Druck auszuhalten vermag, ohne zu platzen, so schließen wir weiter, daß sich nach einer gewissen Zeit ein Gleichgewichtszustand ausbildet, der natürlich dann vorhanden ist, wenn der osmotische Druck der Zuckermoleküle gleich ist der Spannung der Membran. Der nach Innen gerichtete Druck der gespannten Membran nach Eintritt des Gleichgewichtszustandes, d. h. wenn eine weitere Wölbung der Membran nicht mehr erfolgt, ist gleich dem osmotischen Drucke der Lösung.
[5]
Auch in folgender Weise gelangt man zu einer Vorstellung über den osmotischen Druck. Wenn wir bei Beginn des Versuches die Membran belasten, etwa durch Auflegen von Gewichtsteinen, so erfolgt das Eindringen des Wassers langsamer als eben und bei einer gewissen Belastung wölbt sich die Membran überhaupt nicht. Beträgt die betreffende Belastung p kg pro 1 cm2 Oberfläche, so ist p ein Maß für den osmotischen Druck.
Nach der kinetischen Theorie der Flüssigkeiten kommt der osmotische Druck dadurch zustande, daß Zuckermoleküle gegen die Membran prallen und Stöße auf diese ausüben.
Auf die für den osmotischen Druck gültigen Gesetze, die übrigens, wie van ’t Hoff zeigte, mit den Gasgesetzen übereinstimmen, soll nicht näher eingegangen werden; es sei nur bemerkt, daß der osmotische Druck mit der Konzentration wächst.
Die elektrolytische Dissoziation. Man fand, daß die Lösungen von Säuren, Salzen und Basen (Elektrolyte) einen anormal hohen osmotischen Druck haben. Arrhenius erklärte diese Erscheinung durch die Annahme, daß sich Moleküle der gelösten Substanz dissoziieren. Eine einfache Überlegung zeigt uns aber, daß die Dissoziation in Elektrolyten von der gewöhnlichen Dissoziation verschieden sein muß. Wählen wir als Beispiel eine Salmiaklösung. Bei hoher Temperatur spaltet sich (dampfförmiger) Salmiak nach der Gleichung
NH4Cl = NH3 + HCl.
Würde die Dissoziation in der Salmiaklösung in derselben Weise erfolgen, so müßte die Flüssigkeit freies Ammoniak enthalten, das an seinem scharfen, stechenden Geruch leicht erkannt werden kann. Eine[6] Salmiaklösung riecht aber nicht nach Ammoniak. Die Dissoziation in Elektrolyten erfolgt nun in der Weise, daß elektrisch geladene Komponenten entstehen. Das Kochsalzmolekül z. B. spaltet sich in ein positiv geladenes Natriumatom und ein negativ geladenes Chloratom. Die Komponenten nennt man Ionen, d. h. die Wandernden, weil sie sich unter dem Einflusse elektrischer Kräfte bewegen.
Die elektrolytische Dissoziation kann man als einen chemischen Prozeß auffassen, der sich zwischen einem Molekül der gelösten Substanz und einem Neutron[3] abspielt und den man für Kochsalz durch die Gleichung versinnlichen kann:
NaCl + ⊕ - ⊖ = Na-⊕ + Cl-⊖.
Statt dessen schreibt man kürzer
NaCl = Na· + Cl′.
Dementsprechend sehen wir die Ionen als neue chemische Verbindungen an, z. B. ist das Natriumion (Na·) eine chemische Verbindung zwischen einem Natriumatom und einem positiven Elektron. Ebenso wie Natrium + Chlor etwas ganz anderes ist wie Natrium allein, so ist Natrium + Elektron, d. h. Natriumion, in seinem chemischen und physikalischen Verhalten durchaus verschieden von dem metallischen Natrium.
Der materielle Bestandteil eines Ions kann auch aus mehreren Atomen bestehen, z. B. aus der Hydroxylgruppe, dem Radikale SO4. Ist das Element oder die Atomgruppe mehrwertig, so verbindet es sich mit mehreren[7] Elektronen. Beispiele für die elektrolytische Dissoziation:
NaOH = Na· + OH′ (Hydroxylion)
CuSO4 = Cu·· + SO4′′ (Sulfat-Ion).
NH4Cl = NH4· + Cl′
Cu·· bedeutet, daß das Kupferatom mit zwei positiven Elektronen verbunden ist.
Da ein- und derselbe Elektrolyt (Salz) sich in Wasser stark, in Chloroform fast garnicht dissoziiert, so scheint es als ob dem Wasser eine besonders große dissoziierende Kraft innewohnt. Nernst wies zuerst darauf hin, daß zwischen dem Dissoziationsvermögen einer Flüssigkeit und der Dielektrizitätskonstante ein gewisser Parallelismus besteht.
In einem Elektrolyten, z. B. in verdünnter Salzsäure, befinden sich neben den Molekülen des Wassers, von dessen Dissoziation wir einstweilen absehen, nichtdissoziierte Moleküle der gelösten Substanz, positive Ionen, nämlich die Wasserstoffionen, und negative Ionen, nämlich die Chlorionen. Nur bei sehr starker Verdünnung sind sämtliche Moleküle der gelösten Substanzen dissoziiert. Befinden sich n Moleküle der gelösten Substanz (dissoziierte Moleküle + indissoziierte Moleküle) in einer Lösung und sind von diesen m Moleküle dissoziiert, so ist mn der Dissoziationsgrad.
In jedem noch so kleinen Tröpfchen des Elektrolyten befinden sich ebensoviele positive Ionen wie negative, so daß das Tröpfchen als Ganzes unelektrisch ist.
Inbezug auf den osmotischen Druck verhalten sich die Ionen wie die Moleküle der gelösten Substanz; auf eine semipermeable Wand üben sie also einen Druck aus. Man wird hier wieder an das Verhalten der Gase erinnert: Befinden sich in einem abgeschlossenen Raume gleichzeitig mehrere Gase oder Dämpfe, so übt jedes Gas einen gerade so großen Druck aus, wie wenn es allein[8] vorhanden wäre. Bei einem Elektrolyten kommen also, wenn wir von den Ionen des Wassers selbst absehen, drei osmotische Drucke in Betracht, nämlich der osmotische Druck der nichtdissoziierten Moleküle, derjenige der positiven Ionen und derjenige der negativen Ionen.
Auf die Frage, warum in einem Elektrolyten (in der Regel) nicht alle Moleküle der gelösten Substanz dissoziiert sind, soll mit einigen wenigen Worten eingegangen werden. Nach der eben mitgeteilten Auffassung ist die elektrolytische Dissoziation ein Vorgang nach Art eines chemischen Prozesses. Für einen solchen gilt das Massenwirkungsgesetz[4]. Wenn wir also beispielsweise Salzsäure in Wasser gießen, so bildet sich ein Gleichgewichtszustand aus, der dadurch charakterisiert ist, daß die Anzahl der Moleküle, die in 1 Sekunde zerfallen, gerade so groß ist wie die Anzahl der durch Wiedervereinigungen eines positiven und negativen Ions entstehenden neutralen Moleküle. — Würden sich in einer starken Lösung, etwa in einer 30prozentigen Kochsalzlösung alle Moleküle der gelösten Substanz dissoziieren, so würde der Abstand zwischen den einzelnen Ionen ein außerordentlich kleiner sein; die entgegengesetzten Ladungen der positiven und negativen Ionen würden sich so stark anziehen, daß zahlreiche Wiedervereinigungen stattfinden würden. Man sieht ein, daß in jedem Kubikzentimeter der Lösung nur eine bestimmte Anzahl von Ionen existieren kann. Mit zunehmender Verdünnung muß also die Dissoziation fortschreiten.
Elektrolyse. Nur diejenigen Flüssigkeiten leiten den elektrischen Strom, in denen sich freie Ionen befinden. Die Stromleitung in[9] einem Elektrolyten besteht nun darin, daß die von der positiven Elektrode abgestoßenen und von der negativen Elektrode angezogenen positiven Ionen nach der einen und die negativen nach der entgegengesetzten Richtung wandern. Die Geschwindigkeit, mit der sich die Ionen durch die Flüssigkeit hindurch bewegen, die übrigens wegen der sehr großen Reibung zwischen den Wassermolekülen und den Ionen eine sehr geringe ist, hat für die verschiedenen Ionenarten verschiedene Werte.
Bei der Elektrolyse geben die an den Elektroden ankommenden Ionen an diese ihre Ladungen ab, sie werden entionisiert oder gehen in den atomistischen („gewöhnlichen‟) Zustand über. In manchen Fällen gehen nach der Entionisierung sekundäre (rein chemische) Prozesse vor sich. Wird z. B. CuSO4 = Cu·· + SO4′′ zwischen Kupferelektroden elektrolysiert, so verbindet sich das SO4-Radikal (nach seiner Entionisierung) mit einem Atom Kupfer der Elektrode zu CuSO4[5].
Die dem Elektrolyten zugeführte Energie kann also in zwei Teile zerlegt werden. Der eine Teil dient dazu, die Ionen zu bewegen; die entsprechende Arbeit wird in Wärme umgesetzt. Die zweite Arbeit, die der Strom leistet, besteht darin, daß die Ionen ihrer Ladungen beraubt werden. — Die Entionisierung eines Ions, z. B. eines Natriumions kann man als einen chemischen Prozeß auffassen, an dem das Natriumion und ein negatives Elektron beteiligt ist und bei dem Energie verbraucht wird.
Das Faradaysche Gesetz erscheint vom Standpunkte der Ionentheorie aus als etwas Selbstverständliches. Man sieht nämlich ohne weiteres ein, daß
[10]
1. die zersetzten Mengen des Elektrolyten den durchgegangenen Elektrizitätsmengen proportional sind und daß
2. die Mengen der gleichzeitig aus verschiedenen Elektrolyten ausgeschiedenen Stoffe ihren chemischen Äquivalenten proportional sind (an chemisch äquivalente Stoffmengen sind gleiche Elektrizitätsmengen gebunden). An 1 Gramm Wasserstoffionen sind 96540 Coulomb gebunden; ebenso an 23 Gramm Natriumionen etc. Um 1 Gramm Wasserstoff durch Elektrolyse irgend eines Elektrolyten zu erhalten, muß man der Stromquelle 96540 Coulomb positive Elektrizität entnehmen, oder bei 1 Ampere Stromstärke muß die Elektrolyse 96540 Sekunden lang dauern.
Wir wollen jetzt noch im Besonderen betrachten die Elektrolyse der verdünnten Schwefelsäure. Aus dem Umstande, daß chemisch reines Wasser den elektrischen Strom nur sehr schlecht leitet, muß man folgern, daß sich in reinem Wasser nur eine geringe Anzahl von Ionen befindet. In chemisch reinem Wasser können sich natürlich nur solche Ionen befinden, die durch Dissoziation der Wassermoleküle selbst entstehen. Diese spalten sich, allerdings nur zu einem sehr kleinen Prozentsatze, nach der Gleichung
H2O = H· + OH′
(1).
Hierzu kommt wahrscheinlich eine noch geringfügigere Dissoziation, die zur Bildung von Wasserstoff und Sauerstoffionen führt:
H2O = H· + H· + O′′
(2).
Aus der von Kohlrausch und Heydweiller bestimmten Leitfähigkeit des Wassers kann man den Dissoziationsgrad berechnen. Man findet, daß bei 0 Grad 1 g Wasserstoffionen (und dementsprechend 17 g Hydroxylionen, wenn wir von der Dissoziation nach Gleichung[11] 2 absehen) in etwa 14 Millionen Liter Wasser enthalten sind, bei 18° schon in 6,25 . 106 l. Die Leitfähigkeit nimmt also mit der Temperatur schnell zu. Nach neueren Messungen enthält 1 g Wasserstoff 0,352 . 1024 Atome. Ein Gramm Wasser enthält also trotz der sehr geringen Dissoziation viele Millionen Wasserstoffionen.
Die Anzahl der Wasserstoffionen, die sich in 1 cm3 Wasser befindet, wollen wir die Konzentration der Wasserstoffionen nennen, entsprechendes gilt für die anderen Ionen. Da die Leitfähigkeit des Wassers (wie aller Elektrolyte) mit der Temperatur stark wächst, so müssen wir schließen, daß entweder die Ionenkonzentrationen mit der Temperatur größer werden, oder daß die Reibung zwischen den Ionen und den Wassermolekülen kleiner wird oder daß beides zugleich stattfindet. So viele Ionen nun bei einer bestimmten Temperatur in einem cm3 existieren können, so viele existieren auch wirklich. Wenn also aus einem gegebenen Volumen Wasser ein Wasserstoff- und ein Hydroxylion auf irgend eine Weise entfernt werden, so dissoziiert sich sofort ein neues Molekül Wasser — das gestörte chemische Gleichgewicht wird sofort wieder hergestellt.
Es sei hier wieder auf eine Analogie aufmerksam gemacht. Befindet sich in einem abgeschlossenen Raume, etwa unter einer Glasglocke (Rezipient einer Luftpumpe) eine hinreichende Menge Wasser, so verdampft bei einer bestimmten Temperatur eine bestimmte Menge Wasser. Entfernen wir auf irgend eine Weise einen Teil des Wasserdampfes, so erfolgt neue Verdampfung; der Gleichgewichtszustand wird gestört und bildet sich von neuem. Wie bei diesem Vorgange eine gewisse Zeit vergeht, ehe sich der Gleichgewichtszustand von neuem gebildet hat, so auch bei der elektrolytischen Dissoziation.
Setzen wir reinem Wasser Schwefelsäure zu — es genügt eine ganz kleine Menge —, so wächst das Leitungsvermögen[12] sehr stark, und wir schließen daraus, daß sich eine große Menge von neuen Ionen gebildet haben. Diese entstehen durch die Dissoziation der Schwefelsäure, die bei den für uns in Betracht kommenden Konzentrationen eine sehr weitgehende ist, und zwar verläuft der Zerfall nach den beiden Reaktionsgleichungen[6]
H2SO4 = H· + HSO4′
(3).
HSO4′ = H· + SO4′′
(4).
Es findet also eine stufenweise Dissoziation statt. Die Dissoziation nach der Gleichung (3) entspricht dem Zerfall des NaHSO4, der offenbar nach der Gleichung
NaHSO4 = Na· + HSO4′
erfolgt.
Bei geringerer Konzentration der Schwefelsäurelösung spielt die Dissoziation nach Gleichung (3) nur eine ganz untergeordnete Rolle gegenüber der Reaktion
H2SO4 = H· + H· + SO4′′
(5).
Mit wachsender Konzentration tritt die Dissoziation im Sinne der Gleichung (3) mehr in den Vordergrund.
In verdünnter Schwefelsäure befindet sich also eine größere Anzahl von Ionenarten (H·, OH′, O′′, SO4′′, HSO′4), und daher sind verschiedene Elektrolysen möglich. An der Kathode werden immer Wasserstoffionen entionisiert, an der Anode aber können vier verschiedene Ionenarten herauselektrolysiert werden.
Welche Ionenart auch außer Wasserstoff abgeschieden werden mag, an der Stromleitung innerhalb des Elektrolyten sind alle Ionenarten beteiligt.
Um aus einem Elektrolyten zwei verschiedene Ionenarten dauernd herauszuelektrolysieren, muß man eine gewisse Minimalspannung anwenden; für uns kommen[13] folgende von Le Blanc angegebene Zersetzungsspannungen in Betracht:
| H· | und | O′′ | 1,08 | Volt | - | + Überspannung | |
| H· | „ | OH′ | 1,68 | „ | |||
| H· | „ | SO4′′ | 1,95 | „ | |||
| H· | „ | HSO4′ | 2,60 | „ |
Die angegebenen Zersetzungsspannungen genügen i. A. noch nicht, eine sichtbare Gasentwickelung herbeizuführen, man muß diese vielmehr um einen von der Natur der Kathode abhängigen Betrag vergrößern[7] (natürlich ist hier nicht der Spannungsabfall im elektrolytischen Apparat, i × w, gemeint).
Wenn sichtbare Gasentwickelung erfolgen soll, so müssen sich Gasbläschen bilden. Man kann nun annehmen, daß für die Bildung der Bläschen eine gewisse Arbeit verbraucht wird, die der elektrische Strom liefern muß, und daß diese Arbeit von der Beschaffenheit der Oberfläche, an der die Wasserstoffbildung erfolgt, abhängig ist (Überspannung).
Am kleinsten ist die Überspannung für platiniertes Platin (Kathode), für blankes Platin ist sie nahezu 0,1 Volt. Höchst wichtig ist für uns die Überspannung für Blei, die nach Caspari 0,64 Volt beträgt[8]. Bei der Ladung eines Akkumulators ist die Bleielektrode Kathode; daher kann, wenn wir von der sehr geringfügigen Elektrolyse, die den Ionen H· und O′′ entspricht, im Akkumulator eine Gasentwickelung erst bei 1,68 + 0,64 = 2,32 Volt erfolgen; starke Gasentwickelung wird erst bei noch höherer Spannung[14] vor sich gehen (abgesehen von der Überspannung des Sauerstoffs[9]).
Wegen der Überspannung ist also eine Ladung des Akkumulators erst möglich, bezw. kann eine solche ohne ganz erhebliche Energieverluste erfolgen.
Bei kleinen Spannungen, z. B. bei 0,5 Volt, sinkt der Strom in einem Wasserzersetzungsapparat nicht völlig auf Null herab, es muß also auch in diesem Falle eine Elektrolyse stattfinden. Man erhält nicht Gase von Atmosphärendruck, sondern Wasserstoff und Sauerstoff von geringer Konzentration, gelöst in den Elektroden und im Elektrolyten. Den Strom bezeichnet man als Reststrom (s. S. 29).
In dem durch Elektrolyse gewonnenen Sauerstoff finden sich immer Spuren von Ozon, das durch einen sekundären Prozeß aus dem abgeschiedenen Sauerstoff entsteht (besonders bei größerer Stromdichte).
Die Ozonbildung nimmt mit wachsender Konzentration der Säure zu. Ebenso entsteht sekundär Wasserstoffsuperoxyd[10] (H2O2) in geringer Menge, wahrscheinlich an beiden Elektroden. Endlich ist zu erwähnen, daß sich Überschwefelsäure bilden kann nach der Gleichung
2HSO4′ + 2⊕ = H2S2O8
(6).
also primär. Die Entstehung von Überschwefelsäure bei der Elektrolyse der verdünnten Schwefelsäure wird durch große Stromdichte, Vergrößerung des Schwefelsäuregehaltes und Erniedrigung der Temperatur begünstigt. Nach den Zersetzungsspannungen auf Seite 13 dürfte aber, vorausgesetzt, daß die Überschwefelsäure[15] nach Gleichung (6), also primär, entsteht, ihre Bildung erst bei Spannungen von mehr als 2,6 Volt erfolgen; hierzu ist noch beim Bleiakkumulator, da mit den HSO4-Ionen gleichzeitig Wasserstoffionen an der Bleielektrode entionisiert werden müssen, die Überspannung von 0,64 Volt zu addieren. Bei normaler Ladung wäre demnach eine Bildung von Überschwefelsäure im Akkumulator ausgeschlossen. Da übrigens die Überschwefelsäure Blei angreift und Bleisuperoxyd in Bleisulfat verwandelt, so ist ihre Gegenwart in dem Elektrolyten dem Akkumulator schädlich.
Ehe wir uns zu der Polarisation wenden, wollen wir uns mit der Beziehung zwischen der Wärmetönung und der elektromotorischen Kraft beschäftigen. Verdünnte Schwefelsäure möge zwischen indifferenten Elektroden, d. h. zwischen solchen, die durch die Produkte der Elektrolyse nicht angegriffen werden, zersetzt werden (z. B. zwischen Platinelektroden). Wir erhalten, wenn wir von den Nebenprodukten absehen, Wasserstoff und Sauerstoff. Nehmen wir an, daß wir 1 Gramm Wasserstoff durch Elektrolyse erhalten haben (und 8 Gramm Sauerstoff); es sind dann im ganzen 96540 Coulomb durch unseren Apparat geflossen, was der Fall war, wenn die Zersetzung bei 1 Ampère Stromstärke 96540 Sekunden lang gedauert hat. Der erhaltene Wasserstoff werde verbrannt; wir erhalten dann 9 Gramm Wasser. Lassen wir die Verbrennung im Kalorimeter vor sich gehen, so finden wir, daß wir etwa 34200 kleine Wärmeeinheiten (Grammkalorien, cal.) erhalten. Um diese Energie sind 9 Gramm Wasser von gewöhnlicher Temperatur ärmer als 1 g H + 8 g O von derselben Temperatur. Wollen wir nun, so schließen wir vorläufig, das eben gewonnene Wasser wieder in seine beiden Komponenten zerlegen, so müssen wir die[16] eben gewonnene Energie, die wir die Wärmetönung des Prozesses
2H + O = H2O,
bezogen auf 1 Gramm H, nennen, dem Wasser wieder zuführen. Geschieht also die Zersetzung mittels des elektrischen Stromes, so müssen wir, abgesehen von der Jouleschen Wärme, in den elektrolytischen Apparat eine den 34200 cal. äquivalente Menge elektrischer Energie hineinschicken. Die elektrische Energie aber, die ein Apparat verbraucht, ist gegeben durch das Produkt
Anzahl Coulomb × Spannung zwischen den Elektroden.
Da nun die Anzahl Coulomb eine gegebene Größe ist, nämlich 96540, und außerdem das Produkt einer gegebenen Wärmemenge äquivalent ist (34200 cal.), so muß die Klemmenspannung einen bestimmten Wert haben.
Bezeichnen wir diese Spannung mit E, so gilt die Beziehung
96540 . E Wattsek. (Volt-Coulomb) äquival. 34200 cal.
1 Wattsekunde ist aber gleichwertig 0,239 cal. Daher
96540 . E.0,239 = 34200 oder
23070 . E = 34200.
E ist also ungefähr gleich 1,5 Volt. Man sollte nun erwarten, daß eine Zersetzung des Wassers mit einer geringeren Spannung als 1,5 Volt nicht möglich ist. Von verschiedenen Forschern wurde aber nachgewiesen, daß man bei geeigneter Versuchsanordnung mit elektromotorischen Kräften in der Nähe von 1,1 Volt Gasentwickelung beobachtet[11]. Die von uns gezogenen[17] Schlüsse entsprechen demnach nicht den Erfahrungstatsachen; wir müssen uns daher noch eingehender mit der Beziehung zwischen der chemischen und elektrischen Energie beschäftigen.
Thomsonsche Regel. In den galvanischen Elementen, zu denen wir auch den Akkumulator zu rechnen haben, entsteht die elektrische Energie, die das Element abgibt, aus chemischer Energie. Wir wählen als Beispiel das Daniell-Element: Zn in ZnSO4 + aq und Cu in CuSO4 + aq, weil bei ihm die Vorgänge leicht zu übersehen sind. Gibt das Element Strom ab, so geht Zink in Lösung, und Kupfer schlägt sich auf der positiven Elektrode nieder.
Beide Vorgänge kann man durch eine Gleichung ausdrücken
Zn + CuSO4 = Cu + ZnSO4
(7).
Der durch die Gleichung (7) dargestellte Vorgang ist mit Wärmeentwicklung verbunden; dies kann man dadurch leicht nachweisen, daß man auf Zinkspäne Kupfervitriollösung gießt. Dann löst sich Zink, und Kupfer wird abgeschieden. In der Daniell-Kette gehen die Lösung des Zinks und die Fällung des Kupfers an verschiedenen Stellen vor sich. Das Element möge 96540 Coulomb abgegeben haben. Es hat sich dann 1 Grammäquivalent[12] Zink (65 2 Gramm) gelöst[18] und 1 Grammäquivalent = 63,52 g Kupfer hat sich niedergeschlagen. Die dem ganzen chemischen Umsatze entsprechende Wärme, die man die Wärmetönung des Elementes nennt, werde mit q bezeichnet. Man nahm früher an, daß die elektromotorische Kraft eines galvanischen Elementes durch die Wärmetönung allein bestimmt sei. Bei dieser Annahme gelangt man zu der vorhin entwickelten Gleichung
e = q23070,
die man die Thomsonsche Regel nennt. Diese liefert, auf das Daniell-Element angewandt, einen mit der Erfahrung gut übereinstimmenden Wert, weil, wie wir später sehen werden, seine elektromotorische Kraft von der Temperatur unabhängig ist. Bei anderen Elementen findet man aber einen Unterschied zwischen der berechneten und gemessenen elektromotorischen Kraft; ganz versagt die Thomsonsche Regel bei den Konzentrationsketten[13].
Thomson ging von der Voraussetzung aus, daß die ganze dem chemischen Umsatze entsprechende Energie[19] und nur diese im Elemente in elektrische Energie umgewandelt werde, daß sich also das Element während der Stromabgabe weder erwärme noch abkühle. (Wenn übrigens hier und im folgenden von der Erwärmung eines Elementes die Rede ist, so soll die betreffende Wärme nicht als Joulesche Wärme aufgefaßt werden. Wir nehmen an, daß diese durch die Wahl sehr großer Elektroden, die einen kleinen Abstand haben, verschwindend klein gemacht sei.) Diese Voraussetzung trifft aber im allgemeinen, wie durch experimentelle Untersuchungen von Braun, Raoult u. a. nachgewiesen wurde, nicht zu.
Durch Anwendung des zweiten Hauptsatzes der mechanischen Wärmetheorie[14] auf die galvanischen Elemente gelangte Helmholtz zu der Gleichung
E = q23070 + c . T.
w ist wieder die Wärmetönung, entsprechend dem chemischen Umsatz bei einer Stromentnahme von 96540 Coulomb, T ist die absolute Temperatur[15] und c der „Temperaturkoeffizient‟. Um diesen neuen Begriff zu erklären, wählen wir als Beispiel den Akkumulator. Die Säure eines geladenen Akkumulators habe das spezifische Gewicht 1,15. Durch sehr genaue Messungen findet man, daß die elektromotorische Kraft mit der Temperatur wächst und zwar für 1° um 0,0004 Volt. Die Zahl 0,0004 ist der Temperaturkoeffizient unseres Akkumulators; c gibt also hier an, um wieviel Volt die elektromotorische Kraft steigt, wenn die Temperatur der Substanzen des Akkumulators um 1° Celsius erhöht wird.
[20]
Bei dem gewählten Beispiele ist c positiv. In dem Akkumulator wird also nicht nur die dem chemischen Umsatz entsprechende chemische Energie (Wärmetönung) in elektrische Energie umgewandelt, sondern auch noch Wärme, die zunächst den Substanzen des Elementes und dann der Außenwelt entzogen wird. — Bei 17° Celsius ist die elektromotorische Kraft des Akkumulators bei der angenommenen Säuredichte um 290 . 0,0004 = 0,116 Volt größer, als sie nach der Thomsonschen Regel sein müßte.
Für die Daniellsche Kette ist der Temperaturkoeffizient gleich Null, so daß die Helmholtzsche Relation in die Gleichung E = q23070 übergeht.
Wenn einer Erhöhung der Temperatur eine Abnahme der elektromotorischen Kraft eines Elementes entspricht, so ist der Temperaturkoeffizient negativ. In diesem Falle liefert die Thomsonsche Regel einen zu großen Wert für die elektromotorische Kraft, und das Element erwärmt sich während der Stromabgabe, indem ein Teil der Wärmetönung als Wärme zum Vorschein kommt.
Die Helmholtzsche Relation gilt nur für umkehrbare oder reversibel arbeitende Elemente; kann man umgekehrt nachweisen, daß für ein Element die Helmholtzsche Relation gilt, so ist es ein umkehrbares.
Wir sind hier auf die Einteilung der galvanischen Elemente in umkehrbare und nichtumkehrbare gestoßen, die kurz besprochen werden soll: Zu den umkehrbaren Elementen gehört das uns schon bekannte Daniell-Element. Den stromliefernden Prozess können wir durch die Gleichung
Zn + CuSO4 = ZnSO4 + Cu
darstellen, d. h. Zink geht aus dem metallischen Zustand in den Ionenzustand und Kupfer aus dem Zustand des[21] Ions in den metallischen über. Hat das Element 96540 Coulomb abgegeben, so hat es eine Arbeit von 96540 . 1,1 Watt geleistet, vorausgesetzt daß die elektromotorische Kraft 1,1 Volt beträgt. Nach der angegebenen Stromentnahme schicken wir durch das Element den Strom einer Thermosäule (oder irgend einer anderen Stromquelle), dessen Richtung die umgekehrte ist, wie die des Entladestromes; jetzt geht Zink aus dem Zustand des Ions in den metallischen und Kupfer aus dem metallischen Zustand in den des Ions über; die im Elemente sich abspielenden Vorgänge, können durch die Gleichung
ZnSO4 + Cu = CuSO4 + Zn
dargestellt werden. Die Umkehrbarkeit tritt schon äußerlich zutage; denn, die letzte Gleichung ist die Umkehrung der vorletzten. Wir können beide Gleichungen vereinigen zu
CuSO4 + Zn ⇄ ZnSO4 + Cu.
Für die Entladung ist diese Gleichung von links nach rechts, für die Ladung von rechts nach links zu lesen.
Bei der Ladung müssen wir eine elektromotorische Kraft anwenden, die etwas größer ist als diejenige des Elementes. Ist aber der innere Widerstand der Kette sehr klein und der Ladestrom nicht groß, so unterscheidet sich die für die Ladung erforderliche Spannung nur um einen sehr kleinen Betrag von der elektromotorischen Kraft des Elementes, und wir können praktisch die Ladespannung zu 1,1 Volt annehmen. Soll während der Stromzufuhr genau soviel Cu in Lösung gehen, wie sich bei der Stromabgabe niedergeschlagen hatte, so müssen wir in das Element gerade soviel Elektrizität hineinschicken, wie wir ihm entnommen hatten, bei unserer Annahme also 96540 Coulomb.[22] Wenn dieses geschehen ist, so haben wir das Element wieder in seinen ursprünglichen Zustand zurückversetzt, und hierzu bedarf es einer elektrischen Energie von 96540 . 1,1 Watt.
Der Nutzeffekt ist also theoretisch gleich 100%. In Wirklichkeit liegen die Verhältnisse etwas anders, weil sowohl bei der Ladung als auch bei der Entladung der innere, selbst bei großen Elementen nicht unbedeutende Widerstand überwunden werden muß[16]. Infolgedessen ist bei der Entladung die nutzbare Spannung, die Klemmenspannung, kleiner als 1,1 Volt, während die bei der Ladung aufzuwendende E.M.K. größer als 1,1 Volt ist (siehe auch Polarisation durch Konzentrationsänderungen).
Die vorigen Betrachtungen lassen sich nicht auf das Voltasche Element
Zink | verd. Schwefelsäure | Kupfer
übertragen. Bei dieser Kette geht bei Stromentnahme Zink in Lösung, und Wasserstoff wird frei (an der Kupferplatte). Der stromliefernde Prozeß kann demnach durch die Gleichung
Zn + H2SO4 = ZnSO4 + H2
dargestellt werden.
Bei der Ladung wird das Zink nicht wieder gebildet; es bildet sich vielmehr Kupfersulfat (Kupfer geht in Lösung), und es wird auch jetzt Wasserstoff frei:
Cu + H2SO4 = CuSO4 + H2.
Man kann also durch Elektrizitätszufuhr das Element nicht wieder in seinen ursprünglichen Zustand zurückversetzen. Nach Entnahme und darauf folgender Zufuhr von je 96540 Coulomb ist ein Grammäquivalent[23] Zink und ein Grammäquivalent Kupfer in der Lösung, und zwei Grammäquivalente Wasserstoff sind in Freiheit gesetzt, so daß also ein gewisser chemischer Umsatz zu verzeichnen ist, für den eine Kompensation vorhanden sein muß. Die bei der Ladung dem Element zugeführte elektrische Energie muß größer sein als die bei der Entladung gewonnene. Da aber die Strommenge in beiden Fällen dieselbe ist (96540 Coulomb), so muß die Ladespannung größer sein als die elektromotorische Kraft des Elementes. „Dies ist nur möglich, wenn durch den Transport von Elektrizität eine elektromotorische Gegenkraft geweckt wird, d. h. wenn das Element sich polarisiert‟. (Nernst, Theoretische Chemie.) Das Voltasche Element, von dem die Rede war, ist ein nichtumkehrbares.
Unsere Betrachtungen über galvanische Elemente haben uns zu der Erscheinung der Polarisation geführt, die bei der Elektrolyse der verdünnten Schwefelsäure, von der wir ausgegangen sind, eine sehr wichtige Rolle spielt. Bevor wir die Polarisation vom Standpunkte der Ionentheorie betrachten, wollen wir uns Klarheit verschaffen über die osmotische Theorie der Stromerzeugung. Als Ausgangspunkt diene ein Nichtelektrolyt, und zwar wählen wir eine Zuckerlösung. Der feste Zucker, in Wasser gebracht, hat die Tendenz, seine Moleküle in das Wasser zu treiben (man vergleiche hiermit die Verdampfungstension). Der osmotische Druck der bereits in Lösung gegangenen Zuckermoleküle wirkt der Lösungstension entgegen, er sucht Zuckermoleküle auf die Zuckerstückchen zu befördern. Solange die Lösung nichtgesättigt ist, überwiegt der Lösungsdruck (die Lösungstension). Dieser ist also gleich dem osmotischen Drucke einer gesättigten Zuckerlösung.
[24]
Wir haben also ähnliche Verhältnisse wie bei der Verdampfung; der Verdampfungstension wirkt der Dampfdruck entgegen, und die Verdampfung geht solange vor sich, bis sich die beiden Kräfte das Gleichgewicht halten.
Nach der Nernstschen Theorie hat jedes Metall, das in Wasser oder in eine Lösung eingetaucht wird, mehr oder weniger das Bestreben sich zu lösen; man muß den Metallen also eine Lösungstension zuschreiben. Von anderen Substanzen unterscheiden sich die Metalle aber wesentlich dadurch, daß sie nicht anders als positiv geladen, d. h. in Gestalt positiver Ionen, in Lösung zu gehen imstande sind. Man bezeichnet daher ihre Lösungstension als elektrolytische. Befinden sich in der Lösung Ionen des betreffenden Metalles, so wirkt der osmotische Druck dieser Ionen der Lösungstension entgegen.
Fig. 1.
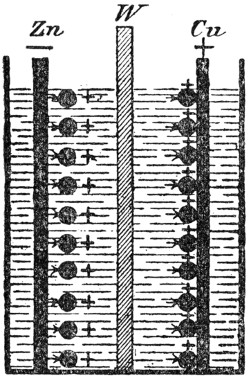
Das Zink hat eine außerordentlich hohe Lösungstension, sie ist größer als der höchste erreichbare osmotische Druck der Zinkionen in Zinksalzlösung. Taucht man daher eine Zinkstange in Zinksulfatlösung ein, so treibt das Zink Ionen in die Lösung hinein, wie dies in Fig. 1 schematisch angedeutet ist. Infolgedessen wird das Metall negativ elektrisch und die Flüssigkeit in nächster Nähe positiv.
Die in die Lösung getriebenen Zinkionen befinden sich in unmittelbarster Nähe des Zinkstabes und werden von der negativen Elektrizität der Elektrode angezogen. Wie man leicht einsieht, wirkt die elektrostatische Anziehung („ungleichnamige Elektrizitäten ziehen sich gegenseitig an‟) in demselben[25] Sinne wie der osmotische Druck der vorhandenen Zinkionen und entgegen der Lösungstension. Sie erreicht wegen des außerordentlich kleinen Abstandes der beiden Ladungen, schon wenn ganz minimale Mengen Zink in Lösung gegangen sind, einen außerordentlich hohen Wert. Noch ehe wägbare Mengen Zink in Lösung gegangen sind, hat sich ein Gleichgewichtszustand ausgebildet.
Die Lösungstension des Kupfers ist klein; sie ist kleiner als der osmotische Druck selbst sehr stark verdünnter Kupfersulfatlösungen. Wenn man also einen Kupferstab in Kupfervitriollösung eintaucht, so gehen, getrieben durch den osmotischen Druck, Kupferionen aus der Lösung auf den Kupferstab; das Kupfer wird also positiv und die Flüssigkeit negativ elektrisch. Auch hier bildet sich bald ein Gleichgewichtszustand aus. Das Potential macht an der Grenze Metall — Flüssigkeit einen Sprung.
Wenn man beim Daniell-Element den Zinkstab und die Kupferelektrode miteinander verbindet, so fließt positive Elektrizität von der Kupfer- und negative von der Zinkelektrode weg, das Gleichgewicht an beiden Elektroden wird gestört, so daß neues Zink in Lösung gehen und neues Kupfer sich auf der positiven Elektrode niederschlagen kann. An der einen Elektrode werden also positive Ionen in den Elektrolyten hinein-, an der anderen aus dem Elektrolyten herausgedrückt.
Wir wollen jetzt annehmen, daß wir verdünnte Schwefelsäure zwischen Platinelektroden elektrolysieren. An der Kathode wird Wasserstoff frei. Platin hat nun die Fähigkeit, Gase, besonders Wasserstoff, zu absorbieren. Man kann sich hiervon leicht durch den Augenschein überzeugen: Man schalte in den Stromkreis ein Amperemeter ein; obschon dieses bei Stromschluß einen stärkeren Strom anzeigt, beobachtet[26] man doch nicht sofort das Auftreten von Gasblasen. Das unmittelbar nach Stromschluß entwickelte Gas dringt in das Platin ein und zwar zunächst in eine unendlich dünne an der Oberfläche liegende Schicht, es wird gelöst (okkludiert). Ferner wird ein Teil des nach Stromschluß frei gewordenen Wasserstoffs bezw. Sauerstoffs von dem Elektrolyten absorbiert.
Fig. 2.
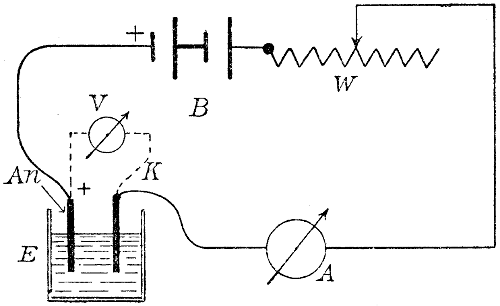
Wir haben also, wenn der zersetzende Strom, der primäre Strom, kurze Zeit durch den Wasserzersetzungsapparat geflossen ist, eine mit Wasserstoff und eine mit Sauerstoff beladene Elektrode in verdünnter Schwefelsäure vor uns, und diese Kombination ist ein galvanisches Element, die sogen. Knallgaskette. Unterbrechen wir den primären Strom, so fließt bei der Schaltung nach Fig. 2[17] ein Strom durch das Voltmeter (Polarisationsstrom). Die elektromotorische Kraft unserer Gaskette nimmt nach Abschaltung der den Zersetzungsstrom liefernden Stromquelle schnell ab, auch wenn man ihr keinen Strom entnimmt, indem die von den Elektroden absorbierten Gase in die Flüssigkeit und in die tieferen[27] Schichten der Elektroden hineindiffundieren, sodaß die Konzentration der Gase in den Elektroden kleiner wird.
Sobald die Elektrolyse der verdünnten Schwefelsäure beginnt, wird unser elektrolytischer Apparat in eine Knallgaskette umgewandelt. Die abgeschiedenen Gase haben das Bestreben, in den Ionenzustand zurückzukehren, und es wird eine elektromotorische Gegenkraft geweckt. Diese sucht einen Strom ins Leben zu rufen, der den Batteriestrom bekämpft. Das Auftreten einer elektromotorischen Gegenkraft in einem elektrolytischen Apparate nennt man Polarisation[18].
Die bei der Elektrolyse des Wassers auftretende Polarisation ist von verschiedenen Umständen abhängig, von der Natur, Gestalt, Größe der Elektroden, von den Veränderungen, die sie während der Elektrolyse erleiden, von den Konzentrationsänderungen des Elektrolyten an den Elektroden, von der Stromdichte etc.
Um eine Gaselektrode zu erhalten, steckt man ein platiniertes Platinblech von unten in ein oben geschlossenes Rohr, dessen unterer Teil in den Elektrolyten eintaucht. Das Rohr sei mit dem betreffenden Gase (z. B. Wasserstoff) derart gefüllt, daß sich das Platinblech zum großen Teil im Gase befindet, zum kleinen Teile in der Flüssigkeit (Fig. 3). Das platinierte Platin absorbiert eine gewisse Gasmenge, es ist selbst elektromotorisch nicht tätig, dient nur als Zu- und Ableiter der Elektrizität. „Vermöge seines Lösungsvermögens für Gase kommt ihm die Fähigkeit zu, den Übergang aus dem Gas- in den Ionenzustand und umgekehrt ohne Hindernis zu gestatten. Eine solche Elektrode, z. B. eine Wasserstoffelektrode, gehört, wie Le Blanc experimentell gezeigt hat, zu der Klasse der umgekehrten Elektroden (wie Kupfer in Kupfersulfatlösung).[28] Dieselbe Arbeit, die wir beim freiwilligen Übergang aus dem Gas- in den Ionenzustand gewinnen können, müssen wir aufwenden, um den Vorgang rückgängig zu machen.‟ (Le Blanc, Lehrbuch der Elektrochemie, S. 162.)
Fig. 3.
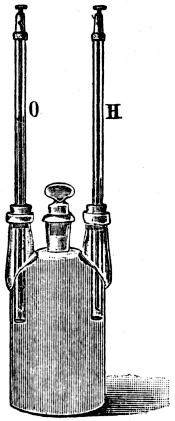
Tauchen zwei Gaselektroden der beschriebenen Art, und zwar eine von Wasserstoff und eine von Sauerstoff bespülte, in verdünnte Schwefelsäure (s. Fig. 3), so erhält man eine Knallgaskette, die längere Zeit, falls der entnommene Strom eine gewisse Stärke nicht überschreitet, eine konstante elektromotorische Kraft hat. Der Vorgang in der Kette ist nach Glaser folgender: Die Sauerstoffelektrode sendet Sauerstoffionen in den Elektrolyten[19]. Dort verbinden sie sich mit zwei Wasserstoffionen zu Wasser. Das überschüssige SO4-Ion veranlaßt zwei Atome des okkludierten Wasserstoffs als Ionen in die Lösung zu treten[20]. Der stromliefernde Prozeß ist also die Vereinigung von Wasserstoff und Sauerstoff zu Wasser.
Die elektromotorische Kraft der Knallgaskette hängt von dem Drucke ab, unter dem die Gase stehen. Von diesem Drucke hängt die Konzentration des Gases (nicht der Ionen) in der Lösung und von dieser die Konzentration des in der Elektrode absorbierten Gases ab; je[29] größer aber diese letztere Konzentration ist, um so größer wird die elektrolytische Lösungstension des Gases, um so größer auch die elektromotorische Kraft.
Bei Atmosphärendruck beträgt die elektromotorische Kraft der Knallgaskette etwa 1,1 Volt. Erniedrigt man den Druck, so nimmt die elektromotorische Kraft ab; ist der Druck der beiden Gase so klein, daß er nahezu Null ist, so hat die elektromotorische Kraft einen sehr kleinen Wert. Schalten wir eine elektromotorische Kraft entgegen (d. h. verbinden wir den positiven Pol einer fremden Stromquelle mit der Sauerstoffelektrode usw.), die die elektromotorische Kraft der Knallgaskette nur um einen ganz geringen Betrag übertrifft, so wird das zwischen den Elektroden befindliche Wasser zersetzt.
Die Wasserzersetzung zwischen platinierten Platinelektroden ist daher ein reversibler Vorgang oder die Knallgaskette gehört zu den umkehrbaren Elementen.
Für den Fall, daß die Elektrolyse sichtbare Gasblasen liefert, ist die Zersetzungsspannung, d. h. die Potentialdifferenz der beiden Elektroden, um die anodische und kathodische Überspannung größer als die elektromotorische Kraft der Knallgasketten (ca. 1,1 Volt). Le Blanc wies nach, daß die Mindestspannung bei Platinelektroden 1,68 Volt beträgt.
Berücksichtigen wir, daß die elektromotorische Kraft der Knallgaskette mit abnehmendem Drucke der beiden Gase kleiner wird, so ergibt sich das höchst beachtenswerte Resultat, daß die zur Zersetzung des Wassers aufzuwendende Energie von einem sehr kleinen Betrage bis zu einer gewissen Höhe variieren kann.
Auch dann, wenn man einen Wasserzersetzungsapparat mit einer Stromquelle verbindet, deren elektromotorische Kraft kleiner als 1,1 Volt ist, fließt, wie man an einem eingeschaltenen Galvanometer[30] erkennen kann, Strom durch die Zelle. Da nach Unterbrechung des Stromes ein Polarisationsstrom nachweisbar ist, so muß eine Elektrolyse stattgefunden haben. Man kann dies folgendermaßen erklären: Beim Einschalten ist noch keine elektromotorische Gegenkraft vorhanden; es fließt also Strom durch die Zelle, und es werden geringe Mengen H und O an den Elektroden abgeschieden. Diese werden von den unmittelbar an der Oberfläche liegenden (unendlich dünnen) Schichten der Elektroden absorbiert, und es entsteht eine Gegenspannung. Da dann der absorbierte Wasserstoff bezw. Sauerstoff in die tiefer gelegenen Schichten der Elektrode und in die umgebende Flüssigkeit hineindiffundiert, so sinkt die Gegenspannung. Würde diese Gasabgabe nicht erfolgen, so würde bald die Gegenspannung gleich der elektromotorischen Kraft der Stromquelle sein und der Strom verschwinden.
Außer der Gaspolarisation kommen bei galvanischen Elementen und bei der Elektrolyse noch Störungen in Betracht, die durch Konzentrationsänderungen innerhalb des Elektrolyten verursacht werden.
Die beiden Ionenarten eines Elektrolyten erfahren zwar, falls sie gleich große Ladungen haben, gleichen Antrieb in dem Felde zwischen den Elektroden, sie haben aber, da ihre Beschaffenheit (Masse, Größe) nicht die gleiche ist, verschiedene Widerstände zu überwinden (Hittorf).
Infolge ungleicher Wanderungsgeschwindigkeit der beiden Ionenarten wird nun der Elektrolyt in der Nähe der einen Elektrode stärker, in der Nähe der anderen Elektrode schwächer konzentriert.
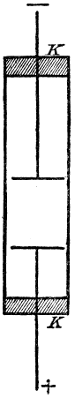
Elektrolysiert man z. B. Kupfervitriollösung zwischen Kupferelektroden, so wird, obschon der gesamte Gehalt an CuSO4 unverändert bleibt, der Elektrolyt in der Nähe der positiven Elektrode reicher und in der Nähe der Kathode ärmer an CuSO4; die Konzentrationsänderungen werden bei größerer Stromdichte nach etwa 1 Stunde ohne weiteres sichtbar, wenn man als elektrolytischen[31] Apparat eine Röhre benutzt, deren Achse vertikal gerichtet ist, wie es in der Fig. 4 angedeutet ist. Indirekt kann man die Konzentrationsunterschiede dadurch nachweisen, daß man nach Abschaltung der den Zersetzungsstrom liefernden Stromquelle die Elektroden mit einem Galvanoskop verbindet. Die elektromotorische Kraft der Konzentrationskette, in die sich ein elektrolytischer Apparat bei (längerem) Stromdurchgang verwandelt, ist der elektromotorischen Kraft der Batterie ebenfalls entgegengesetzt gerichtet.
Fig. 4.
Wie sich aus den vorhergehenden Betrachtungen ergibt, ist die Polarisation bei der Elektrolyse der verdünnten Schwefelsäure keineswegs eine konstante Größe. Man kann sich hiervon leicht in folgender Weise überzeugen: Man messe bei verschiedenen Stromstärken i1, i2, i3 die Klemmenspannung des Wasserzersetzungsapparates; die gefundenen Werte seien e1, e2, e3. Unter der Annahme, daß die Polarisation konstant sei, berechne man aus je zweien der drei Gleichungen
i1 = e1 - ew, i2 = e2 - ew, i3 = e3 - ew
(e = elektromotorische Kraft der Polarisation)
den Widerstand w des elektrolytischen Apparates; man erhält dann für w Werte, die sehr verschieden sind.
Wir haben früher durch (vorläufige) energetische Berechnungen das Resultat abgeleitet, daß die Spannung, die für die Zersetzung des Wassers nötig ist, etwa 1,5 Volt betragen müßte; andererseits haben wir gesehen, daß man schon bei elektromotorischen Kräften von etwa 1,1 Volt eine Elektrolyse des Wassers beobachtet hat. Es fragt sich, wie man den (scheinbaren) Widerspruch beseitigt. Zunächst ist zu berücksichtigen, daß bei der Elektrolyse des Wassers keineswegs der Prozeß
2H + O = H2O
[32]
rückgängig gemacht wird[21]; das wäre richtig, wenn durch den Strom erst eine Zerlegung der Wassermoleküle in ihre beiden Komponenten bewirkt würde. Die Tätigkeit des Stromes besteht aber darin, daß vorhandene Ionen in den atomistischen Zustand übergeführt werden; es spielen sich also bei der Elektrolyse die den folgenden Gleichungen entsprechenden Vorgänge ab:
| 2H· + 2⊖ = 2H[22] | |||
| O′′ + 2⊕ = O bezw. | |||
| 2OH′ + 20⊕ = 2OH und | |||
| H + H = H2 | - | Molekülbildung | |
| O + O = O2 | |||
| bezw. 2OH = H2O + O. | |||
Wir sind gar nicht berechtigt, zu behaupten, daß die diesen Prozessen entsprechende Energie gleich ist der Wärmetönung des Vorganges, bei dem sich Wasserstoff und Sauerstoff miteinander verbinden[23]. Ferner haben wir gesehen, daß bei gewissen galvanischen Elementen nicht nur die der Wärmetönung entsprechende Energie in elektrische umgewandelt wird, sondern auch noch[33] Wärme, die den Substanzen des Elementes bezw. der Außenwelt entzogen wird: dementsprechend dürfen wir bei der Elektrolyse nicht erwarten, daß die Zersetzungsspannung durch die Wärmetönung allein bestimmt sei.
Die Helmholtz’sche Relation gilt, wie wir gesehen haben, für umkehrbare galvanische Elemente. Ist die Knallgaskette ein umkehrbares Element, so dürfen wir auf dasselbe die Helmholtz’sche Gleichung anwenden. Smale fand, wie bereits bemerkt wurde, daß bei 1,1 Volt[24] zwischen Palladiumelektroden, die bekanntlich Wasserstoff sehr stark absorbieren, eine sichtbare Gasentwicklung stattfand. Bei mäßiger Entladung zeigte das Gaselement bei 20° Celsius dieselbe elektromotorische Kraft (also 1,1 Volt). Wenden wir die Helmholtz’sche Relation an, so ergibt sich die Gleichung:
1,1 = 3420023070 + c . 293.
Hieraus ergibt sich für den Temperaturkoeffizient c der Wert -0,0014. Durch Messungen ergab sich, daß der Temperaturkoeffizient den aus der Helmholtz’schen Gleichung gefundenen Wert hat. Die Wasserzersetzung resp. Wasserbildung mit 1,1 Volt ist also ein reversibler Prozeß.
[1] Die Frage, welche Verbindung des Bleies mit Sauerstoff sich bildet, ist unwesentlich. Aus dem vorhandenen Oxyde bildet die Säure wahrscheinlich zuerst Bleisulfat, und dieses wird zu Blei reduziert.
[2] Allerdings nicht vollständig; mit wachsendem Druck wird der Unterschied in der Durchlässigkeit immer kleiner.
[3] Schon Helmholtz hatte in seiner Faraday-Rede der Elektrizität eine atomistische Struktur zugeschrieben. Die Elektrizitätsatome sollen im Folgenden als Elektronen bezeichnet werden; für diese wählen wir die Symbolen ⊕ und ⊖. Die Elektronen sehen wir als neue einwertige Elemente an. Ein positives Elektron kann sich mit einem negativen vereinigen zu einem Neutron ⊕-⊖.
[4] Dieses wurde von zwei schwedischen Forschern, Guldberg und Waage, aufgestellt. Näheres siehe Nernst, Theoretische Chemie.
[5] Dieses oder ein anderes vorhandenes Kupfersulfatmolekül spaltet sich elektrolytisch, so daß das SO4-Ion neu gebildet wird. Der Effekt ist also derselbe, als ob ein Kupferatom der positiven Elektrode, mit Elektrizität beladen, also als Ion, in die Lösung gegangen wäre. Nimmt man dieses an, so ist der ganze Vorgang rein primär.
[6] S. Nernst, Theoretische Chemie, 4. Aufl., S. 468.
[7] Caspari, Zeitschr. für physik. Chemie, 1899, 30, 89.
[8] Bei höherer Stromdichte (Anzahl Ampere pro 1 dm2) wächst die Überspannung noch und erreicht ihren maximalen Wert erst, nachdem die Elektrolyse längere Zeit in Gang gehalten worden ist. Ähnliches gilt für die anodische Überspannung.
[9] Coehn und Osaka, Zeitschr. für anorganische Chemie, 1903, 34, 86.
[10] Näheres s. H. Danneel, Spezielle Elektrochemie, S. 44, und über die Bildung von Überschwefelsäure ebendaselbst S. 67.
[11] Smale benutzte Palladiumelektroden, die bekanntlich die abgeschiedenen Gase, besonders Wasserstoff in hohem Grad zu absorbieren vermögen; er beobachtete schwache Gasentwicklung bei 1,062 Volt (Arrhenius, Lehrbuch d. Elektrochemie, 1901, S. 241). Nernst und Glaser (ebenso Bose) konnten nachweisen, daß eine sichtbare Gasentwicklung schon bei 1,08 Volt eintritt, wenn man eine kleine Platinspitze als Kathode und eine große platinierte Platinplatte (eine unpolarisierbare Elektrode) als Anode benutzt. Bei dieser Spannung werden die Sauerstoff- und Wasserstoffionen entladen. Über den Reststrom s. S. 14 und 29.
[12] Aus der Formel
| H2O | schließen | wir, | daß | 1 g | H | bindet | 8 g | O; | 8 g | O | = 1 | Grammäquiv. | O. |
| HCl | „ | „ | „ | 1 g | H | „ | 35,5 g | Cl; | 35,5 g | Cl | = 1 | „ | Cl. |
| Na(OH) | „ | „ | „ | 23 g | Na | ersetzen | 1 g | H; | 23 g | Na | = 1 | „ | Na. |
Aus den Formeln H2SO4 und ZnSO4 schließen wir, daß 65 g Zn ersetzen 2 g H, oder daß 652 g Zn äquivalent sind 1 g H usw. Chemisch äquivalente Mengen enthalten im Ionenzustand gleiche Elektrizitätsmengen (Faraday’sches Gesetz). 1 Grammäquivalent enthält im Ionenzustand 96540 Coulomb.
[13] Schichtet man z. B. über eine starke Kupferchloridlösung eine schwache Lösung desselben Salzes und taucht in beide Lösungen Kupferelektroden ein, so findet man, daß ein Galvanoskop, dessen Klemmen man mit den Elektroden verbindet, einen Strom anzeigt. An der einen Elektrode geht Kupfer in Lösung, an der anderen schlägt sich Kupfer nieder. Die elektrische Energie entsteht hier überhaupt nicht aus chemischer Energie.
[14] Näheres siehe Ostwald, Entwicklung der Elektrochemie, Leipzig 1910.
[15] Ist t die Temperatur in Celsius-Graden, so ist 273 + t = T die absolute Temperatur.
[16] Auch aus anderen Gründen ist das Element als Akkumulator praktisch nicht brauchbar.
[17] B = Batterie, W = Kurbelrheostat, A = Ampèremeter, V = Voltmeter, An = Anode, K = Kathode.
[18] Von einer Gaspolarisation kann beim Bleiakkumulator höchstens gegen Ende der Ladung die Rede sein.
[19] Alle negative Ionen liefernde Elemente haben einen hohen Lösungsdruck.
[20] Vor Stromschluß verhinderte der osmotische Druck der Wasserstoffionen innerhalb des Elektrolyten das Eindringen der Wasserstoffionen. — Verschwinden aus der Säure zwei Wasserstoffionen, so ist das Gleichgewicht gestört.
[21] Das geschieht, wenn man Wasserdampf sehr stark erhitzt.
[22] Das Wasserstoffion hat einen anderen Energieinhalt als das Wasserstoffatom, d. h. dem oben angegebenen Prozesse entspricht eine Wärmetönung. Diese ist allerdings im vorliegenden Falle nicht groß, bei anderen Ionen aber hat sie bedeutende Werte.
[23] Wenn man eine Säure und eine Base, beide in wässeriger Lösung, mischt, so verbinden sich Wasserstoff- und Hydroxylionen zu Wasser. Beim Zusammentreten von 1 Gramm Wasserstoffionen mit der entsprechenden Menge OH-Ionen werden 13700 cal. frei. Wir dürfen daher annehmen, daß, wenn durch elektrolytische Dissoziation des Wassers 1 Gramm H-Ionen entsteht, 13700 cal. verbraucht werden. Diese Wärme wird dem Wasser bezw. der Umgebung entzogen. Man ist daher eher berechtigt zu sagen: die Wärmetönung, die der Elektrolyse des Wassers entspricht, ist (34200-13700) cal., als zu behaupten, sie beträgt 34200 cal.
[24] Die elektromotorische Kraft, die der Bildung von Wasser aus den Elementen, beide von Atmosphärendruck, entspricht, wird neuerdings zu 1,23 Volt angegeben (siehe Handbuch der anorganischen Chemie. 2. Band, 1. Abteilung. S. 85).
[34]
Die Geschichte des Akkumulators beginnt mit Ritters Entdeckung der Polarisationsströme. Sinsteden erhielt besonders kräftige Polarisationsströme, als er statt Platin Blei benutzte. Das Verdienst aber, die Bedeutung des Bleies für die Aufspeicherung der elektrischen Energie erkannt zu haben, gebührt Planté[25]. Seine ersten Versuche fielen in die Mitte des vorigen Jahrhunderts, 1879 trat er mit seiner Erfindung hervor (s. auch Kap. 6).
Chemische Theorie. Zunächst soll die Stromerzeugung im Bleiakkumulator besprochen werden, ohne daß auf die Ionentheorie Rücksicht genommen wird, d. h. vom rein chemischen Standpunkte aus.
Planté war der Ansicht, daß nur die Elemente des Wassers bei der Ladung und Entladung an den chemischen Veränderungen, die sich an den Elektroden abspielen, beteiligt seien. Welche Oxydationsstufe des Bleies sich an der positiven Elektrode bildet, läßt Planté offen. Das Bild, das er sich von den Vorgängen verschafft hat, dürfte etwa folgendes sein: Bei der Entladung[35] wird Bleisuperoxyd (PbO2) durch Wasserstoff, der durch die Zersetzung des Wassers frei wird, in eine niedrigere Oxydationsstufe verwandelt, und Blei wird durch Sauerstoff oxydiert. Das durch den Strom zersetzte Molekül Wasser wird an der positiven Elektrode wieder gebildet. Mithin müßte das spezifische Gewicht der Säure während der Entladung konstant bleiben. Die Erfahrung lehrt uns aber, daß dies nicht der Fall ist. Die Änderungen der Säuredichte während der Ladung und Entladung hatte Planté zwar auch beobachtet, aber merkwürdiger Weise nicht bei der Aufstellung der Theorie verwertet.
Im Laufe der Zeit sind eine ganze Reihe von Theorien über die chemischen Vorgänge im Akkumulator aufgestellt worden, von denen verschiedene den Grundsätzen der physikalischen Chemie ganz und gar widersprechen. Es soll hier nur diejenige Theorie besprochen werden, die, wie Dolezalek in seinem bekannten Werke über Akkumulatoren[26] sagt, bis auf den heutigen Tag alle Anfechtungen siegreich bestanden hat; es ist dies die Sulfattheorie, als deren Begründer die englischen Forscher Gladstone und Tribe (1883) anzusehen sind. Nach dieser Theorie bildet sich bei der Entladung an beiden Elektroden Bleisulfat; die Vorgänge können durch die beiden folgenden Gleichungen dargestellt werden:
+Elektrode: PbO2 + H2 + H2SO4 = PbSO4 + 2H2O,
-Elektrode: Pb + SO4 = PbSO4.
Durch Addition erhalten wir die dem ganzen stromliefernden Prozeß entsprechende Gleichung:
PbO2 + Pb + 2H2SO4 = 2PbSO4 + 2H2O
(1).
[36]
Fig. 5.
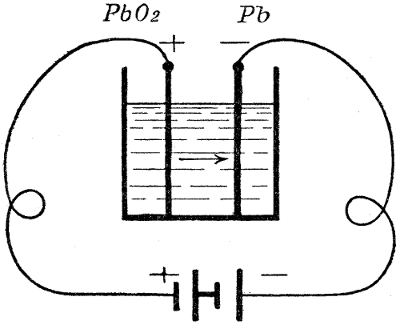
Bei der Ladung (s. Fig. 5) tritt der Strom an der positiven Elektrode in die Flüssigkeit ein. Da der Wasserstoff mit dem Strom wandert, so wird er jetzt an der negativen Platte frei (bei der Entladung an der positiven Elektrode). Die Prozesse, die sich bei der Ladung abspielen, entsprechen den folgenden Gleichungen:
+Elektrode: PbSO4 + SO4 + 2H2O = PbO2 + 2H2SO4
-Elektrode: PbSO4 + H2 = Pb + H2SO4.
Addiert man die beiden Gleichungen und zieht auf beiden Seiten 1 Molekül Schwefelsäure ab, so erhält man
2PbSO4 + 2H2O = PbO2 + Pb + 2H2SO4
(2).
Die beiden Gleichungen (1) und (2) kann man zu einer einzigen zusammenfassen:
PbO2 + Pb + 2H2SO4 ⇄ 2PbSO4 + 2H2O
(3).
Während der Ladung wird also Wasser verbraucht und Schwefelsäure gebildet, so daß unsere Gleichung der bekannten Tatsache Rechnung trägt, daß die Säuredichte bei Stromzufuhr größer wird; während der Entladung wird nach unserer Gleichung Schwefelsäure verbraucht und Wasser gebildet, so daß die Konzentration der Säure abnimmt.
Wir wollen zunächst die in unserer Gleichung vorkommenden Substanzen kurz besprechen und vor allem zusehen, wieviel Gramm von jeder einzelnen pro Amperstunde verbraucht oder gebildet werden.
[37]
Das Bleisuperoxyd hat eine braunrote Farbe. Es leitet in der festen Form, wie es auf den Platten der Akkumulatoren vorkommt, nach Streintz[27] die Elektrizität halb so gut wie Quecksilber. Der Verbrauch pro Amperstunde kann folgendermaßen berechnet werden. Auf 2 Atome Wasserstoff, die herauselektrolysiert werden, kommt gemäß der Gleichung
PbO2 + H2 + H2SO4 = PbSO4 + 2H2O
ein Molekül PbO2, das umgewandelt wird; auf 1 Gramm Wasserstoff kommen also (206,5 + 32):2 = 119,25 g Bleisuperoxyd. Da durch 96540 Coulomb 1 Gramm Wasserstoff abgeschieden wird, so werden durch 1 Amperstunde = 3600 Coulomb an Wasserstoff 360096540 = 0,0373 g entwickelt. Der Verbrauch an PbO2 pro Amperstunde beträgt also 119,25 . 0,0373 g = 4,46 Gramm.
2) Das Blei ist ein weiches Metall von hohem spezifischen Gewichte; sein elektrochemisches Äquivalent ist, da es zweiwertig ist, 206,52 = 103,25, also ein sehr hohes (man vergleiche hiermit das Äquivalentgewicht des dreiwertigen Aluminiums). Da die Träger der aktiven Masse, d. h. der an dem chemischen Umsatze beteiligten Stoffe, aus Blei bestehen müssen, so ist der Bleiakkumulator ein schwerer Akkumulator. Das aktive Blei ist porös, schwammig (Bleischwamm). Pro Amperstunde, die der Akkumulator abgibt, müssen 0,0373 × 206,52 = 3,85 g Bleischwamm vorhanden sein.
3) Verdünnte Schwefelsäure von der bei Akkumulatoren üblicher Konzentration ist ein Elektrolyt[38] von ausgezeichnetem Leitungsvermögen (näheres siehe Kap. 3). Wenn 2 Atome Wasserstoff zur Abscheidung gelangen, werden, wie man aus den beiden auf die Entladung sich beziehenden Gleichungen ersieht, 2 Moleküle Schwefelsäure verbraucht. Da das Molekulargewicht der Schwefelsäure 98 ist, so kommen auf 1 g Wasserstoff 98 g Schwefelsäure. Verbrauch pro Amperstunde also 3,66 g.
4) Ähnlich findet man, daß pro Amperstunde 18 . 0,0373 = 0,67 Gramm Wasser bei der Entladung frei werden.
5) Das Bleisulfat ist in verdünnter Schwefelsäure nur sehr wenig löslich; infolgedessen bleibt es an den Elektroden haften. Die Löslichkeit hängt von der Säuredichte ab; sie ist bei 1,22 Säuredichte ein Minimum, es lösen sich in 1 l solcher Säure nur 12 mgr.[28].
Beweise für die Richtigkeit der Sulfattheorie oder der Gleichung 3. An der Tatsache, daß sich an der negativen Elektrode bei der Ladung Blei (und nur dieses) bildet, wird wohl kaum noch von jemand gezweifelt; wohl aber wird hier und da bestritten, daß sich an der positiven Platte nur Bleisuperoxyd bildet. So z. B. behauptet Darrieus[29], daß geladene positive Platten Bleisuperoxyd enthalten, das mit Überschwefelsäure durchtränkt ist. Die Bildung von Überschwefelsäure ist bei normalen Verhältnissen aus verschiedenen Gründen unwahrscheinlich; bei Ladung mit sehr hoher Stromdichte, bei der die Klemmenspannung einen hohen Betrag annimmt, ist sie allerdings nicht unmöglich (s. S. 13), indem dann die Dichte der Säure[39] in den Poren der aktiven Masse und in der nächsten Umgebung, wie später gezeigt wird, stark ansteigt, und großer Säuregehalt für die Bildung von Überschwefelsäure günstig ist. Wird aber mit den üblichen Stromdichten geladen, so daß die Spannung nicht über 2,7 bis 2,8 Volt steigt (Ende der Ladung), so ist die Entstehung von Überschwefelsäure höchst unwahrscheinlich.
Der Akkumulator wäre ferner kein umkehrbares Element, wenn Überschwefelsäure entstände, da der betreffende Vorgang nicht reversibel ist; wir werden aber sehen, daß die Helmholtz’sche Gleichung, auf den Akkumulator angewendet, zu einem richtigen Werte für die elektromotorische Kraft führt, daß also der Bleiakkumulator zu den umkehrbaren Elementen zu rechnen ist. Setzt man endlich dem Akkumulator Überschwefelsäure[30] zu, so sinkt die elektromotorische Kraft, während sie bei der Ladung langsam steigt. [Durch Versuche von Mugdan[31] dürfte die Darrieus’sche Theorie übrigens endgültig widerlegt sein.]
Verschiedene Forscher haben durch chemische Analyse nachgewiesen, daß sich Bleisuperoxyd in einer unserer Gleichung entsprechenden Weise bildet. Ferner spricht für die Bildung von Bleisuperoxyd folgender Versuch. Kombiniert man eine geladene positive Akkumulatorplatte in verdünnter Schwefelsäure mit einem amalgamierten Zinkstab, so findet man, daß das betreffende Element eine elektromotorische Kraft von 2,4 Volt hat; ersetzt man die Akkumulatorplatte durch eine Bleiplatte, die mit einem Überzug von künstlich dargestellten PbO2 versehen ist, so hat diese Kombination[40] ebenfalls eine elektromotorische Kraft von 2,4 Volt.
Daß sich bei der Entladung Bleisulfat gemäß unserer Gleichung bildet, kann durch Messungen der Säuredichte nachgewiesen werden. Die einer bestimmten Strommenge entsprechende Abnahme der Konzentration kann nämlich aus der Menge der vorhandenen Säure und dem anfänglichen spezifischen Gewichte derselben leicht berechnet werden. W. Kohlrausch und C. Heim, die diesbezügliche Messungen ausführten, fanden, daß die berechnete Änderung der Säuredichte mit der durch Aräometermessung gefundenen sehr gut übereinstimmt[32].
E. Sieg[33], der die Versuche in dem Laboratorium der Kölner Akkumulatoren-Werke wiederholen ließ, fand, daß die nach unserer Gleichung zu erwartende Bildung von 3,66 Gramm Schwefelsäure nie beobachtet wurde. Wahrscheinlich wurden die gefundenen Abweichungen durch die in den Poren der aktiven Masse eingeschlossene Säure verursacht.
Den Nachweis, daß sich bei der Entladung aus Blei, Bleisuperoxyd und Schwefelsäure im Sinne unserer Gleichung Bleisulfat und Wasser bilden und zwar primär (stromliefernd, wie der chemische Umsatz im Daniell-Elemente), kann man durch thermodynamische Berechnungen führen, indem man nämlich die Helmholtz’sche Relation (s. S. 19) auf den Akkumulator anwendet: Unserer von links nach rechts gelesenen Gleichung (3) entspricht ein bestimmter chemischer Umsatz, bei dem eine gewisse Wärmemenge frei wird (die gesamte Energie des Systems nimmt ab). Die Wärmetönung (Änderung der gesamten Energie),[41] bezogen auf diejenigen Mengen Blei, Bleisuperoxyd und Schwefelsäure, die einer Stromentnahme von 96540 Coulomb entsprechen, sei q. Eine direkte Bestimmung von q im Kalorimeter ist wegen des langsamen Verlaufes der Reaktionen nicht ausführbar. Man kann aber aus bekannten Wärmetönungen die dem Umsatze
Pb + PbO2 + 2H2SO4 = 2PbSO4 + 2H2O
entsprechende Reaktionswärme berechnen. Hierbei benutzt man den Satz der konstanten Wärmesumme; nach diesem ist die Wärmetönung unabhängig von dem Wege, auf dem man ein chemisches System aus einem gegebenen Anfangszustand in einen bestimmten Endzustand überführt[34].
q ist von der Dichte der Akkumulatorsäure abhängig. Wir wollen zunächst annehmen, daß das spezifische Gewicht der Säure 1,044 sei. Nach Streintz ist bei dieser Säuredichte die Wärmetönung q = 42850 cal., nach Tscheltzow beträgt sie 43850. Wir wählen das arithmetische Mittel aus diesen beiden Werten, setzen also
q = 43350 cal.
[42]
Wir müssen noch, ehe wir die Gleichung
E = q23070 + c . T,
anwenden können, den Temperaturkoeffizienten des Akkumulators kennen. Dieser ist zuerst von Streintz experimentell bestimmt worden. Dieser Forscher fand, daß c von der Säuredichte abhängig ist. Bei einer Säuredichte von 1,16 erreicht er ein Maximum, dieses beträgt 0,36 Millivolt pro 1° Temperaturänderung. Dolezalek bestimmte auf theoretischem Wege den Temperaturkoeffizienten und gelangte zu dem Resultate, daß derselbe sowohl positiv wie negativ sein kann. Bei einer Säuredichte von 1,044 ist er[35] gleich Null, bei höheren Konzentrationen ist er positiv, bei niedrigeren negativ. Hat die Akkumulatorsäure die übliche Dichte, nämlich 1,18 bis 1,2 nach beendigter Ladung, so ist c = 0,0004 Volt (angenähert).
Da bei 1,044 Säuredichte (68,6 Gramm H2SO4 pro Liter) c = 0, so muß bei dieser Konzentration die Thomsonsche Regel angewendet werden. Wird also durch unsere Gleichung (3) der chemische Umsatz richtig wiedergegeben, so muß die elektromotorische Kraft
E = 4335023100 = 1,88 Volt sein.
Mißt man die elektromotorische Kraft bei der angegebenen Säuredichte, so findet man den Wert 1,89 Volt.
Bei der gewöhnlichen Säuredichte ist die Wärmetönung etwas kleiner als 43350 cal. Die jetzt anzuwendende Helmholtzsche Relation liefert aber trotzdem[43] einen höheren Wert für die elektromotorische Kraft als den eben gefundenen (1,88 Volt), weil das Glied c . T einen Wert von mehr als 0,1 Volt (bei 17° Celsius) hat. Der berechnete und der gemessene Wert von E stimmen auch jetzt vorzüglich überein.
Da eine ganze Reihe von Beweisen für die Richtigkeit unserer Behauptung beigebracht sind (s. auch S. 45), daß der Akkumulator ein umkehrbares Element ist, in dem sich die chemischen Veränderungen nach der Gleichung (3) vollziehen, da ferner das ganze Verhalten des Akkumulators mit der Reaktionsgleichung im Einklang steht, so dürfte es überflüssig sein, auf andere Theorien näher einzugehen.
Von den Gegnern der Sulfattheorie wird folgender Einwand erhoben. Wenn bei einem umkehrbaren galvanischen Elemente der innere Widerstand sehr klein ist, so darf die für die Ladung nötige Energie nicht oder doch nur sehr wenig verschieden sein von der bei der Entladung entnommenen Arbeit. Beim Bleiakkumulator ist aber das Verhältnis zwischen der abgegebenen und zugeführten elektrischen Energie nur etwa 0,8. Diese Tatsache dürfte mit dem Charakter der Irreversibilität unvereinbar sein.
Ehe wir zeigen, daß gar kein Widerspruch gegen die Sulfattheorie vorliegt, daß man vielmehr mit Hilfe unserer Gleichung die Differenz zwischen Lade- und Entladeenergie zwanglos erklären kann, wollen wir uns beschäftigen mit der Änderung der elektromotorischen Kraft mit der Säurekonzentration[36].[44] Diese wurde zuerst von Streintz nachgewiesen; nach seinen Untersuchungen ist zu Anfang der Entladung
E = 1,85 + 0,917 (s - 1),
wo s das spezifische Gewicht der Säure nach der Ladung ist. Man findet mit Hilfe dieser Gleichung, daß
| für | s = | 1,05 | E = | 1,896 |
| s = | 1,1 | E = | 1,942 | |
| s = | 1,2 | E = | 2,033 | |
| s = | 1,3 | E = | 2,125 | |
| s = | 1,55 | E = | 2,350 |
Diese Werte stimmen mit den durch direkte Messung gefundenen ziemlich gut überein.
Es liegt die Frage nahe, warum man in der Praxis bei einer Säuredichte von 1,1 bis 1,2 geblieben ist. Hier ist zu beachten, daß die Löslichkeit des Bleisulfates bei hohen Konzentrationen stark zunimmt; bei 1,6 Säuredichte ist sie etwa 4 mal so groß wie bei einer Säuredichte von 1,16. Auch tritt bei höheren Säuredichten leichter Sulfatierung ein (s. Kap. 5) und der spezifische Widerstand der verdünnten Schwefelsäure liegt bei der üblichen Säuredichte nahe beim Minimum, bei 1,6 ist er beinahe 3 mal so groß wie bei 1,2.
Wenn noch ein Zweifel an der Richtigkeit der Sulfattheorie bestand, so würde dieser gehoben durch Untersuchungen von Dolezalek über die Abhängigkeit der elektromotorischen Kraft von der Säuredichte; es ergab sich, daß die durch Anwendung der Thermodynamik berechneten Werte vorzüglich mit den experimentell gefundenen übereinstimmten. Der den Berechnungen zu Grunde liegende Gedanke ist folgender:
Zwei Akkumulatoren, die wir mit A und B bezeichnen[45] wollen, seien gegeneinander geschaltet: A enthalte konzentriertere, B verdünntere Lösung (s. Fig. 6). Man findet, wenn man noch ein Galvanoskop einschaltet, daß der Akkumulator A Strom abgibt. A wird also entladen und B geladen.
Fig. 6.
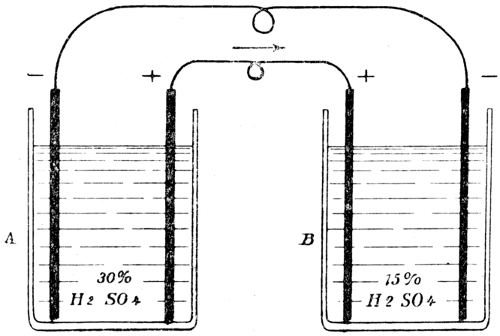
Bei diesen Vorgängen wird
in A eine gewisse Menge PbO2 verbraucht,
in B die gleiche Menge PbO2 erzeugt,
in A eine gewisse Menge Pb verbraucht,
in B die gleiche Menge Pb erzeugt,
in A bildet sich eine gewisse Menge PbSO4,
in B verschwindet die gleiche Menge PbSO4.
Betrachten wir die beiden Akkumulatoren als ein chemisches System, so folgt, daß sich die dem chemischen Umsatze entsprechenden Wärmetönungen, soweit die festen Substanzen in Betracht kommen, gegenseitig aufheben. Ferner ändert sich in beiden Akkumulatoren die Konzentration der Säure, und zwar wird sie in A geringer und in B größer. Die Änderungen der Säuredichte kann man sich nun auch in der Weise vollzogen denken, daß aus A Schwefelsäure nach B und aus B Wasser nach A befördert wird. Diese Transporte (die Wegnahme bezw. der Zusatz von Flüssigkeiten) sind mit einem Arbeitsgewinn verbunden. Es ergibt sich dies aus folgenden Betrachtungen.
Wenn man in Wasser Schwefelsäure gießt, so wird Wärme frei, und zwar ist die Wärmeentwickelung[46] bei der Mischung von a Grammolekül[37] Schwefelsäure und b Grammolekül Wasser nach Thomson
w = a . b1,8 a + b.17860 cal.
Nehmen wir an, daß wir 1 Mol Schwefelsäure nicht auf einmal, sondern in kleinen Quantitäten nach und nach dem Wasser zusetzen, etwa jedesmal 1 Gramm; es wird dann keineswegs bei jedem Zusatz die gleiche Wärmemenge frei, sondern zuerst eine größere als später. Es folgt dies schon aus dem Umstande, daß keine Wärme entwickelt wird, wenn man zu konzentrierter Schwefelsäure reine Schwefelsäure gießt. Wird umgekehrt einer Schwefelsäurelösung Schwefelsäure entzogen, so wird Wärme gebunden, und zwar ist die (negative) Wärmetönung um so kleiner, je größer die Konzentration der Säure ist. Nennen wir also die Wärmeentwickelung, die der Beimischung von a Gramm Schwefelsäure zu der Säure des Akkumulators B entspricht, q1, und den Wärmeverbrauch bei der Wegnahme von a Gramm Schwefelsäure aus A q2, so ist q1>q2. Für die Wärmeentwickelung und den Wärmeverbrauch, mit der die Beimischung und Entnahme des Wassers verbunden ist, gilt das Umgekehrte wie eben. Die Wärmetönung des stromliefernden Prozesses besteht also aus vier Posten, von denen zwei positiv und zwei negativ sind.
Wollen wir die Helmholtz’sche Relation (s. S. 19) auf das System, bestehend aus den beiden gegeneinander geschalteten Akkumulatoren, anwenden, so haben wir für e die Differenz der beiden elektromotorischen Kräfte[47] (ΔE) zu setzen; die in der Gleichung mit c bezeichnete Größe ist nicht etwa der Temperaturkoeffizient eines der beiden Akkumulatoren, vielmehr hat c in dem vorliegenden Falle folgende Bedeutung. A sowohl wie B möge um 1° Celsius erwärmt werden, dann nimmt ΔE einen etwas anderen Wert an, der neue Wert sei ΔE′. Es ist dann
c = ΔE′ - ΔE.
Da man die Temperaturkoeffizienten des Akkumulators für die verschiedenen Säuredichten kennt, so kann man den Temperaturkoeffizienten des Systems und somit auch ΔE bestimmen. Es sind also alle Größen zur Berechnung der elektromotorischen Kraft (ΔE) mit Hilfe der Helmholtz’schen Gleichung bekannt.
Von der Besprechung des anderen Weges, den Dolezalek angibt, die Änderung der elektromotorischen Kraft mit der Säuredichte zu berechnen, soll abgesehen werden. Aus der folgenden Tabelle ist zu ersehen, wie groß die Übereinstimmung zwischen Rechnung und Messung ist.
| Säuredichte | Elektromotorische Kraft | |||
|---|---|---|---|---|
| berechnet | gemessen | |||
| 1,553 | 2,39 | Volt | 2,355 | Volt |
| 1,420 | 2,25 | „ | 2,253 | „ |
| 1,266 | 2,10 | „ | 2,103 | „ |
| 1,154 | 2,06 | „ | 2,008 | „ |
| 1,035 | 1,85 | „ | 1,887 | „ |
Der Berechnung der elektromotorischen Kraft des Akkumulators bei verschiedenen Konzentrationen der Säure liegt die Annahme zugrunde, daß der Verbrauch an Schwefelsäure und die Bildung von Wasser in einer unserer Reaktionsgleichung entsprechenden Weise erfolgt. Die gute Übereinstimmung zwischen den berechneten und den gemessenen Werten der elektromotorischen[48] Kraft kann daher als ein weiterer überzeugender Beweis für die Richtigkeit der Sulfattheorie angesehen werden.
Wir gehen jetzt auf den früher erwähnten Einwand gegen die Sulfattheorie näher ein. Nach dieser wird bei der Ladung des Akkumulators an beiden Elektroden Bleisulfat zersetzt und Schwefelsäure gebildet, und zwar entsteht die Säure sowohl an der Oberfläche der Platten als auch in den Poren der aktiven Masse[38]. Die an den Plattenoberflächen entstandene Säure sinkt, wie man an der sogenannten Schlierenbildung gut erkennen kann, langsam zu Boden. Da aber während der Ladung fortwährend Schwefelsäure entsteht, so ist jede Elektrode in eine sehr dünne Schwefelsäureschicht eingehüllt. Ferner füllt sich kurze Zeit nach Beginn der Ladung jede Pore der aktiven Masse mit stark konzentrierter Säure; diese wird in den Poren mechanisch festgehalten (Kapillarität) und kann nur durch Diffusion in den Elektrolyten außerhalb der Platten gelangen[39]. Die Diffusion aber ist ein Vorgang, der sich nur langsam vollzieht. Die aktive Masse ist also in Berührung mit Säure höherer Konzentration. Da aber die elektromotorische Kraft des Akkumulators mit der Säuredichte nicht unerheblich ansteigt, so ist die Gegenspannung während der Ladung anormal hoch (s. auch S. 82).
Die mittels des Aräometers nachweisbare Zunahme der Konzentration der Säure (zwischen den Platten, die wir die äußere Säure nennen wollen) hat zwar auch ein Wachstum der elektromotorischen[49] Kraft zur Folge. Die dieser Zunahme entsprechende Änderung der elektromotorischen Kraft beträgt nur einige Hundertstel Volt.
Während der Entladung wird an beiden Elektroden Säure verbraucht; die Folge ist, daß die Konzentration der Säure in den Poren der aktiven Masse und unmittelbar an der Oberfläche stark abnimmt. Die elektromotorische Kraft hat daher einen kleineren Wert als denjenigen, welcher der Dichte[40] der äußeren Säure entspricht.
Der Unterschied zwischen Lade- und Entladespannung ist der Hauptgrund für den verhältnismäßig geringen Nutzeffekt (s. S. 73). Da dieser nun mit Hilfe der Sulfattheorie erklärt ist, so liegt natürlich kein Widerspruch vor.
Wenn die Ladespannung deshalb größer wäre, weil die Vorgänge bei der Ladung nicht die umgekehrten sind wie bei der Entladung, so müßte, wenn man plötzlich von der Entladung zur Ladung übergeht oder umgekehrt, die Spannung sich sprungweise ändern; der Versuch zeigt aber, daß dieses nicht der Fall ist.
Falls die aus der Sulfattheorie hergeleitete Erklärung für den Unterschied zwischen Lade- und Entladespannung[50] den Tatsachen entspricht, muß dieser Unterschied, wenn man mit sehr geringer Stromdichte lädt und entlädt, verschwindend klein werden. Ein einfacher Versuch zeigt, daß dieser Schluß der Wirklichkeit entspricht.
Ein Akkumulator von etwa 14 Amperstunden Kapazität (bei 3stündiger Entladung) wurde mit einem Strome von 0,12 Amper geladen. Ein Millivoltmeter von Siemens und Halske mit Vorschaltwiderstand zeigte
| vor Beginn der Ladung | 2,01 | Volt | |||||
| nach | einer | Ladezeit | von | 1 | Min. | 2,02 | „ |
| „ | „ | „ | „ | 15 | „ | 2,03 | „ |
| „ | „ | „ | „ | 35 | „ | 2,04 | „ |
| „ | „ | „ | „ | 45 | „ | 2,04 | „ |
Wurde die Ladestromquelle abgeschaltet und dem Akkumulator sofort ein Strom von 0,12 Amper entnommen, so sank die Spannung nur um 1-2 Millivolt. — Zu beachten ist übrigens bei dem Versuche, daß der durch das Ampermeter gehende Strom nur zum Teil Ladestrom ist, indem der durch das Voltmeter fließende Strom mitgemessen wird. Bei meinem Versuche nahm das Voltmeter 0,11 Amp. auf, so daß die Ladestromquelle 0,23 Amp. abgeben mußte.
Die bisherigen Darlegungen berechtigten zu der Aufstellung der These, daß nur diejenigen Theorien, die über den Bleiakkumulator aufgestellt sind, einer streng wissenschaftlichen Prüfung Stand halten, nach denen der Akkumulator ein umkehrbares Element im Sinne unserer Reaktionsgleichung (Seite 36) ist. — Es sei hier darauf aufmerksam gemacht, daß unsere Gleichung nur besagt, daß das System PbO2 + Pb + 2H2SO4 bei der Entladung übergeht in das System 2PbSO4 + 2H2O und daß bei der Ladung das letztere System in das erstere übergeführt wird. Auf die Frage, wie diese Umwandlung erfolgt, gibt uns natürlich unsere Gleichung keine Auskunft; jedoch müssen alle Vorgänge[51] bei der Ladung stromliefernd (primär) erfolgen, ähnlich wie es bei dem Daniell-Elemente der Fall ist[41].
Der eben genannten Bedingung genügen die Theorie von Le Blanc und diejenige von C. Liebenow, die wir ausführlich besprechen wollen.
Theorie von Le Blanc. I. Entladung. Le Blanc nimmt an, daß Bleisuperoxyd in verdünnter Schwefelsäure in geringem Maße löslich ist. Die in Lösung gegangenen PbO2-Moleküle bleiben aber nicht als solche in der Flüssigkeit, sondern verbinden sich mit Wasser unter Bildung von vierwertigen Bleiionen und Hydroxylionen:
PbO2 + 2H2O = Pb···· + 4OH′
(1).
Da es chemische Verbindungen gibt, in denen das Blei vierwertig ist, so können auch vierwertige Bleiionen existieren; das Salz PbCl4, dessen Existenz nachgewiesen ist, wird sich sicher nach der Gleichung
PbCl4 = Pb···· + 4Cl′
in Wasser dissoziieren. Daß ferner ein chemischer Prozess zu einer Ionenbildung führt, hat nichts Befremdendes mehr, wenn man die Ionen als chemische Verbindungen ansieht (s. S. 6).
Ferner haben Rixon und Elbs[42] nachgewiesen, daß sich in gebrauchter Akkumulatorsäure verhältnismäßig erhebliche Mengen von vierwertigem Blei befinden, nämlich bis 0,17 g Pb(SO4)2 im Liter. Auch wurde festgestellt, daß frisch dargestelltes Bleisuperoxyd in Schwefelsäure zum Teil in Pb(SO4)2 überging:
PbO2 + 2H2SO4 ⇄ Pb(SO4)2 + 2H2O.
Die mit positiver Elektrizität beladenen Bleiionen[52] wandern mit dem Strome und geben, an der positiven Elektrode angelangt, an diese zwei Ladungen ab:
Pb···· = Pb·· + 2⊕.
Von den vier Elektronen sind, so wollen wir zur Erklärung hinzufügen, zwei nur locker gebunden, so daß sie leichter abgegeben werden als die beiden anderen; ähnlich wie Superoxyde leicht ein Atom Sauerstoff verlieren.
Das doppelt geladene Bleiion verbindet sich mit einem SO4-Ion zu einem Molekül Bleisulfat. (Die Konzentration der Bleiionen steigt in den Poren der aktiven Masse stark an, so daß diese das Bestreben haben, den Ionenzustand zu verlassen.) Da Bleisulfat nur in geringem Maße in verdünnter Schwefelsäure löslich ist, so ist der Elektrolyt in den Poren der aktiven Masse und dicht an der Oberfläche der Bleisuperoxydplatte, nachdem sich eine kleine Menge dieses Salzes gebildet hat, mit schwefelsaurem Blei gesättigt; es wird sich also bei Stromentnahme Bleisulfat auf der positiven Elektrode niederschlagen.
Die beiden Ladungen, die das vierwertige Bleiion abgegeben hat, fließen durch die Leitung, gelangen zur negativen Elektrode und gehen mit einem Bleiatom in die Lösung.
Pb + 2⊕ = Pb·· (s. elektrolyt. Lösungstension).
Wie an der positiven Elektrode verbindet sich auch hier das Bleiion mit einem SO4-Ion zu einem Molekül Bleisulfat, das sich niederschlägt.
Zwischen den beiden Elektroden spielen sich folgende Vorgänge ab. Wie wir gesehen haben, werden zwei SO4-Ionen verbraucht, so daß vier Wasserstoffionen im Überschuß vorhanden sind; nun sind aber auch durch die Bildung des vierwertigen Bleiions 4 Hydroxylionen entstanden (siehe Gleichung 1 a. S. 51). Vor der Stromentnahme war aber der Elektrolyt an[53] letzterer Ionenart gesättigt. Die Dissoziation von 4 Molekülen Wasser[43] muß daher zurückgehen; zwischen den Elektroden geht also die Reaktion vor sich
4H· + 4OH′ = 4H2O.
Die verbrauchten Wasserstoff- und SO4-Ionen werden ersetzt durch Dissoziation von 2 Molekülen H2SO4.
Wir wollen die Vorgänge übersichtlich zusammenstellen:
a) An der positiven Elektrode.
1. PbO2-Moleküle gehen in Lösung und verbinden sich nach der Gleichung:
2. PbO2 + 2H2O = Pb···· + 4OH′.
3. Die Bleiionen, die mit dem Strome wandern, geben an die positive Elektrode zwei Ladungen (Elektronen) ab:
Pb···· = Pb·· + 2⊕.
Die beiden Elektronen gehen durch die Leitung hindurch zur Bleiplatte (s. Nr. 6).
4. Pb·· + SO4′′ = PbSO4.
5. Bleisulfat schlägt sich nieder.
b) An der negativen Elektrode.
6. Die beiden angekommenen positiven Elektronen treten, an ein Bleiatom gebunden, durch die elektrolytische Lösungstension getrieben, in den Elektrolyten ein:
Pb + 2⊕ = Pb/ ⊕\ ⊕.
7. Wie bei Nr. 4.
8. Wie bei Nr. 5.
c) Zwischen den Elektroden.
9. 4H· + 4OH′ = 4H2O und
10. 2H2SO4 = 4H· + 2SO4′′.
Addiert man die sämtlichen Gleichungen und kürzt[44], so erhält man die Gleichung
PbO2 + Pb + 2H2SO4 = 2PbSO4 + 2H2O.
II. Ladung. Es wird gezeigt, daß sich jetzt die Vorgänge in umgekehrter Reihenfolge und in umgekehrtem Sinne abspielen.
[54]
Bleisulfat ist in verdünnter Schwefelsäure in geringem Maße löslich. Ein Teil der Bleisulfatmoleküle spaltet sich elektrolytisch nach der Gleichung
PbSO4 = Pb·· + SO4′′.
a) Positive Elektrode.
1. Auflösung von Bleisulfat — Umkehrung von I, 5.
2. Dissoziation des Bleisulfats — Umkehrung von I, 4.
3. Das Bleiion nimmt an der positiven Elektrode noch zwei Ladungen auf
Pb·· + 2⊕ = Pb···· (Umkehrung von I, 3).
4. Erreicht die Konzentration der vierwertigen Bleiionen (die nur in ganz minimaler Menge existieren können) einen gewissen Grad, so verbinden sie sich mit vorhandenen Hydroxylionen zu Bleisuperoxyd und Wasser[45]:
Pb···· + 4OH′ = PbO2 + 2H2O (Umkehrung von I, 2).
5. Bleisuperoxyd ist nur in sehr geringer Menge in der Säure löslich (existenzfähig); es schlägt sich somit in den Poren und auf der Oberfläche[46] der aktiven Masse nieder (Umkehrung von I, 1).
b) Negative Elektrode.
6. PbSO4 geht in Lösung (Umkehrung von I, 8).
7. Dissoziation des Bleisulfates (Umkehrung von I, 7).
8. Das Bleiion wird von der negativen Elektrode angezogen, gibt seine beiden Ladungen ab (geht in den atomistischen Zustand über) und schlägt sich nieder (Umkehrung von I, 6).
[55]
c) Zwischen den Elektroden.
Es sind zwei neue SO4-Ionen in die schon von vornherein mit diesen Ionen gesättigte Lösung gekommen (nämlich durch Dissoziation der beiden Bleisulfatmoleküle); anderseits sind, da vier OH-Ionen verbraucht wurden, vier Wasserstoffionen überschüssig.
Die beiden Ionenarten verbinden sich miteinander zu Schwefelsäure
4H· + 2SO4′′ = 2H2SO4 (Umkehrung von I, 10).
Die verbrauchten Hydroxyl- und Wasserstoffionen werden nachgeliefert durch Dissoziation von vier Molekülen Wasser
4H2O = 4H· + 4OH′ (Umkehrung von I, 9).
Daß auch jetzt Addition aller Gleichungen, Kürzung und Vereinfachung zu unserer Reaktionsgleichung führt, ist selbstverständlich.
Theorie von Liebenow. Auch Liebenow nimmt an, daß Bleisulfat in geringem Maße in der Schwefelsäure löslich sei und sich in Blei- und Sulfationen spalte. Ein wesentlicher Unterschied mit der eben entwickelten Theorie besteht nun darin, daß Liebenow die Entstehung von Bleisuperoxydionen in dem Elektrolyten annimmt. Diese bilden sich entweder dadurch, daß sich ein Teil[47] der vorhandenen Bleiionen mit Sauerstoffionen vereinigt nach der Gleichung
Pb·· + 2O′′ = PbO2′′
oder hydrolytisch (unter Mitwirkung des Wassers):
Pb·· + 2H2O = PbO2′′ + 4H·.
Letzteres wird im folgenden angenommen. Um diese Theorie glaubhaft zu machen, mußte die Existenz[56] von PbO2-Ionen nachgewiesen werden. Diesen Nachweis zu erbringen, gelang Liebenow und Strasser folgendermaßen[48]. Eine Zelle wurde mit Kalilauge gefüllt, die mit Bleioxyd gesättigt war. Die in die Zelle tauchenden Elektroden waren mit einer für die Ionen durchlässigen Hülle umgeben, so daß nach Beendigung des Versuches die jede Elektrode umgebende Flüssigkeit für sich allein analysiert werden konnte. War die Flüssigkeit längere Zeit elektrolysiert worden, so fand man, daß der Bleigehalt des die positive Elektrode umhüllenden Elektrolyten größer geworden war (ungleiche Wanderungsgeschwindigkeit der verschiedenen Ionenarten, s. S. 30).
Daraus folgt, daß sich das Kaliumplumbit Pb(KO)2 nicht in der Weise dissoziiert, daß Bleiionen entstehen. Denn hätten sich Bleiionen gebildet, so wären diese als positive Ionen nach der Kathode hingewandert, und man hätte dort eine Zunahme des Bleigehaltes beobachtet haben müssen. Mithin muß das Blei einen Bestandteil von negativen Ionen bilden, es muß mit negativen Ionen an die Kathode gelangt sein. Man muß also annehmen, daß das Kaliumplumbit sich elektrolytisch nach der Gleichung
Pb(KO)2 = PbO2′′ + 2K·
spaltet, d. h. daß Bleisuperoxydionen existieren.
Wegen der „Überspannung‟ (s. S. 13) werden nun bei Stromzufuhr die Ionen des Bleies und des Bleisuperoxyds leichter, d. h. bei geringerer Klemmenspannung, herauselektrolysiert als die übrigen Ionen, die sich in der verdünnten Schwefelsäure befinden[49]. Obschon[57] die Konzentration der Pb·· und der PbO2′′ eine nur ganz geringe ist, so kann ihre Abscheidung, falls nicht die Stromdichte gar zu sehr gesteigert wird, in einer dem Faradayschen Gesetze entsprechenden Weise erfolgen. Denn sobald ein Bleiion und (gleichzeitig) ein Bleisuperoxydion abgeschieden ist, erfolgt neue Dissoziation von zwei Molekülen Bleisulfat, von denen das eine mit Wasser ein neues Bleisuperoxydion bildet. Das infolge der Elektrolyse verbrauchte Bleisulfat wird dem Elektrolyten zugeführt von dem Vorrate, der an den Elektroden angehäuft ist (bei der vorhergegangenen Entladung entstanden).
Da sich während der Elektrolyse (Ladung) die negative Elektrode mit einer an Dicke allmählich zunehmenden Schicht metallischen Bleies und die positive Platte mit Bleisuperoxyd bedeckt, so wird nach einer gewissen Zeit des Stromdurchganges dem Bleisulfat der Eintritt in die Lösung immer mehr erschwert. Je ärmer der Elektrolyt an Bleisulfat bezw. an Blei- und Bleisuperoxydionen wird, um so mehr muß die Zersetzungsspannung gesteigert werden (s. Ladung, Kap. 4).
Durch Dissoziation der beiden Bleisulfatmoleküle werden 2 neue SO4-Ionen gebildet; diese verbinden sich mit den vier Wasserstoffionen, die durch die Reaktion zwischen dem Bleiion und dem Wasser entstanden sind, zu 2 Molekülen Schwefelsäure.
Wir wollen auch jetzt die Vorgänge bei der Ladung kurz zusammenstellen.
[58]
Bleisulfat löst sich; 2 Moleküle spalten sich:
2PbSO4 = 2Pb·· + 2SO4′′.
Ein Bleiion reagiert mit Wasser:
Pb·· + 2H2O = PbO2′′ + 4H·.
Das Bleiion gibt an der negativen Elektrode seine beiden Ladungen ab und schlägt sich nieder:
Pb·· + 2⊖ = Pb[50].
Das Bleisuperoxydion gibt an der positiven Elektrode seine beiden Ladungen ab und schlägt sich nieder:
PbO2′′ + 2⊕ = PbO2.
Endlich:
4H· + 2SO4′′ = 2H2SO4.
Man überzeugt sich leicht, daß man durch Addition der fünf vorhergehenden Gleichungen die Reaktionsgleichung des Akkumulators erhält.
Es soll noch kurz gezeigt werden, daß sich bei der Entladung alle eben geschilderten Vorgänge in umgekehrtem Sinne abspielen.
Das Blei sendet positive Ionen in die Lösung und wird negativ geladen; an der positiven Elektrode treten Bleisuperoxydionen in den Elektrolyten ein. Da nur ganz minimale Mengen von Blei- und Bleisuperoxydionen in dem Elektrolyten existieren können, so treten die Bleiionen mit SO4-Ionen zu Bleisulfat zusammen, und jedes Bleisuperoxydion vereinigt sich mit vier Wasserstoffionen zu einem Bleiion und zwei Molekülen Wasser:
PbO2′′ + 4H· = Pb·· + 2H2O.
Jetzt ist ein SO4-Ion im Überschuß[51] vorhanden; dieses verbindet sich mit dem neuen Bleiion zu Bleisulfat. Die vier verbrauchten Wasserstoffionen und die[59] beiden dem Elektrolyten entzogenen SO4-Ionen werden neu gebildet durch Dissoziation von zwei Molekülen Schwefelsäure
2H2SO4 = 4H· + 2SO4′′.
Auf das Anwachsen der Klemmenspannung während der Ladung und die allmähliche Abnahme derselben bei der Entladung soll im vierten Kapitel näher eingegangen werden.
[25] Die Untersuchungen sind zusammengestellt in seinem Werke: Recherches sur l’Électricité.
[26] Dolezalek, Die Theorie des Bleiakkumulators.
[27] Siehe die Schrift: Das Akkumulatorenproblem. Sammlung elektrotechnischer Vorträge. S. 3.
[28] Siehe Streintz, l. c. S. 4.
[29] Näheres siehe P. Schoop, Die Sekundär-Elemente. 1. Teil.
[30] Diese greift übrigens Blei leicht an und würde die baldige Zerstörung der Platten herbeiführen.
[31] Zeitschr. f. Elektrochemie, 1899, S. 309.
[32] Die Bildung von Schwefelsäure bei der Ladung kann man bei Zellen mit Glaswänden direkt beobachten (Schlieren); bei der Entladung steigen Schlieren aufwärts.
[33] E. Sieg, Die Akkumulatoren. Leipzig 1901. S. 9.
[34] Folgendes einfaches Beispiel diene zur Erläuterung: Die unbekannte Wärmetönung des Prozesses C + O = CO soll bestimmt werden:
| Addiert: | C + 2O = CO2, | Wärmetönung | pos., | sie | betrage | q1 | cal. |
| CO2 = CO + O, | „ | neg., | „ | „ | -q2 | „ | |
| C + 2O + CO2 = CO2 + CO + O, | Wärmetönung | q1 - q2 | „ | ||||
| oder | C + O = CO | „ | q1 - q2 | „ | |||
Man denkt sich also auf einem Umwege die Bildung von Kohlenoxyd aus Kohlenstoff und Sauerstoff vollzogen: Aus Kohlenstoff und Sauerstoff sei Kohlendioxyd entstanden, dieses sei durch Anwendung hoher Temperatur in Kohlenoxyd und Sauerstoff zerlegt. Die dem letzteren Prozesse entsprechende Wärmetönung ist negativ, weil bei der umgekehrten Reaktion
CO + O = CO2
Wärme gewonnen wird.
[35] Die Änderung der elektromotorischen Kraft mit der Temperatur kann man durch Gegeneinanderschalten zweier Akkumulatoren (+ mit +, - mit - verbunden) demonstrieren, von denen der eine in ein Wasserbad gestellt wird.
[36] Wenn der Elektrolyt an der Stromlieferung (dem chemischen Umsatze) beteiligt ist, so ist eine Änderung der elektromotorischen Kraft mit der Säuredichte zu erwarten. Diejenigen, welche behaupten, daß „die Schwefelsäure nur als elektrolytischer Leiter diene‟ und daß „die Sulfatbildung ein rein sekundärer Prozeß sei‟, müssen folgern, daß die elektromotorische Kraft unabhängig ist von der Säuredichte. — Diesbezügliche Messungen sind an vollgeladenen Zellen vorzunehmen, denen man eine geringe Menge Elektrizität entnommen hat.
[37] Unter einem Grammolekül (abgekürzt „Mol‟) einer Substanz versteht man soviele Gramme der betr. Substanz wie das Molekulargewicht anzeigt. Das Molekulargewicht der Schwefelsäure ist 98, mithin ist ein Mol H2SO4 gleich 98 g H2SO4.
[38] Die Masse, die sich in den Schichten befindet, in denen sich der chemische Umsatz abspielt, nennt man aktive Masse.
[39] Die Diffusionsvorgänge sind von M. U. Schoop näher untersucht worden. Siehe Sammlung elektrotechnischer Vorträge, Bd. V. Stuttgart 1903. F. Enke.
[40] Die Konzentrationsänderungen an beiden Elektroden sind nicht die gleichen. Zunächst nämlich bewirkt die ungleiche Wanderungsgeschwindigkeit der beiden Ionenarten eine Konzentrationsverschiebung, sie strebt die Konzentration an der positiven Elektrode zu erhöhen und an der negativen zu vermindern. Ferner wird durch die Wasserbildung an der positiven Elektrode dort die Konzentration verringert. Drittens spielt die Porosität der aktiven Masse eine Rolle. Je größer nämlich die Porosität ist, umsomehr Säure steht für den chemischen Umsatz im Innern der Platten zur Verfügung, umso weniger sinkt die Konzentration. Mugdan wies nach, daß die Konzentrationspolarisation an der positiven Elektrode die größere ist.
[41] Selbst durch einfache Umsatzgleichungen werden kompliziertere Verhältnisse wiedergegeben. Die Gleichungen sind einfach, weil sie nur den Anfangs- und den Endzustand sowie die Gewichtsverhältnisse angeben. Wenn man auf die Frage, wie sich der Umsatz vollzieht, näher eingeht, so findet man, daß sich auch bei den einfachsten Reaktionen verschiedene Vorgänge abspielen müssen.
[42] Zeitschr. für Elektrochemie, 1903, 9, 267.
[43] 4H2O = 4H· + 4OH′.
[44] Dies ist gestattet, da die zusammenfassende Endgleichung nur angeben soll, welche Substanzen vor und welche nach der Entladung vorhanden sind.
[45] Nennt man die Konzentration der vierwertigen Bleiionen in der mit PbO2 gesättigten Lösung (in den Poren) c1, diejenige der OH-Ionen c2, so erfolgt das Zusammentreten dieser beiden Ionenarten, sobald c1.c2 einen gewissen Wert erreicht hat.
[46] Dort spielen sich nämlich die zur Entstehung des Bleisuperoxydes führenden Vorgänge ab.
[47] Der Einfachheit halber wollen wir im folgenden annehmen, daß von zwei durch Dissoziation des Bleisulfates entstandenen Bleiionen eines in ein Bleisuperoxydion übergeht.
[48] Zeitschr. f. Elektrochemie, 1896, S. 420 und 653.
[49] Die Ionen haben das Bestreben, ihre Ladungen zu behalten, das häufig als Haftintensität bezeichnet wird und mit der chemischen Affinität verglichen werden kann. Diese ist für die verschiedenen Ionenarten verschieden groß. Diejenigen Ionen, deren Haftintensität am geringsten ist, werden am leichtesten, d. h. bei der geringsten Spannung abgeschieden. Damit ist die Möglichkeit gegeben, aus einer Mischung verschiedener Elektrolyte, z. B. zweier Salze, die positiven Ionen nacheinander herauszuelektrolysieren.
[50] Die beiden negativen Ladungen liefert die Stromquelle, ebenso die für die Entionisierung des Bleisuperoxydiones nötige positive Elektrizität.
[51] Den vier H· der vorigen Gleichung entsprechen zwei SO4′′.
[60]
1. Kapazität. Unter der Kapazität eines Akkumulators versteht man diejenige Elektrizitätsmenge, ausgedrückt in Amperstunden, die der Akkumulator, wenn er nach Vorschrift behandelt wird, abgeben kann. Vor allem muß der Akkumulator, wenn man seine Kapazität bestimmen will, vorschriftsmäßig geladen werden (s. Kap. 4); ferner ist zu berücksichtigen, daß bei der Entladung eine gewisse Stromstärke nicht überschritten werden darf; die Entladung hat man als beendigt anzusehen, wenn die anfängliche Spannung um etwa 10% gesunken ist.
Meistens haben die beiden Elektroden eine ungleiche Kapazität; natürlich ist dann praktisch die Kapazität des Elementes durch diejenige der Elektrode mit geringerer Kapazität gegeben.
Bei der gewöhnlichen Säuredichte ist die elektromotorische Kraft des vollgeladenen Akkumulators 2,03 Volt, sodaß man mit der Entladung solange fortfahren kann, bis die Klemmenspannung etwa 1,8 Volt beträgt (nicht die elektromotorische Kraft, s. S. 105). Wird ein Akkumulator mit der konstanten Stromstärke J entladen, und dauert die Entladung in dem angegebenen Sinne t Stunden, so beträgt die Kapazität (bei t-stündiger Entladung) J × t Amperstunden.
[61]
Da die Elektrizität, die ein Akkumulator abgibt, aus chemischer Energie entsteht, so hängt die Kapazität von der Menge des Bleischwammes und der Menge des Bleisuperoxydes ab, die sich in Bleisulfat umwandeln können. Der Umsatz kann natürlich nur dort erfolgen, wo die wirksame Masse mit Schwefelsäure in Berührung steht und wo sie Kontakt mit der Unterlage hat. Die Tiefe, bis zu der die Stromlinien (besser gesagt: Der Elektrolyt) in die Platten eindringen, beträgt nur Bruchteile eines Millimeters; sie ist etwas größer, wenn sich in der aktiven Masse poröse Substanzen befinden. Man ist daher, wenn man die Kapazität eines Akkumulators und damit seine Leistung steigern will, darauf angewiesen, die Oberfläche der Platten zu vergrößern. Es sei hier die Bemerkung eingeschoben, daß man in der Technik zwischen der projizierten Oberfläche, wie sie sich durch Multiplikation von Länge und Breite ergibt, und der wirksamen, d. h. der von dem Elektrolyten benetzten Oberfläche unterscheidet; letztere nennt man auch die abgewickelte Oberfläche. Diese beiden sind umsomehr von einander verschieden, je poröser die aktive Masse ist, und je mehr Rippen, Zähne oder dergleichen sich auf der Platte befinden. Ist die gesamte projizierte Oberfläche der positiven Elektrode a dm2 und die Stromstärke J Amp., so ist Ja die Stromdichte, bezogen auf 1 dm2.
Würde man bei Elementen für größere Leistungen nur eine positive und eine negative Platte benutzen, so würde die Zelle unförmlich große Dimensionen haben. Man vereinigt daher in einem Elemente fast immer mehrere kleinere positive und negative Platten; die gleichnamigen Platten werden durch Bleileisten miteinander[62] verbunden (s. Kap. 7). Die Verwendung mehrerer positiver und negativer Platten gewährt noch einen anderen Vorteil; enthält nämlich eine Zelle nur zwei Platten (eine positive und eine negative), so sind fast nur die beiden sich gegenüberliegenden Oberflächen an der Stromlieferung beteiligt[52], es werden also bei jeder Platte nur etwa 50% der Gesamtoberfläche ausgenutzt. Besteht der Akkumulator aber aus einer positiven und zwei negativen Platten, so sind von 6 Flächen nur 2 an dem chemischen Umsatze im beschränktem Maße beteiligt, d. h. nur etwa 331⁄3% usw.
Die Anzahl der negativen Platten ist immer um 1 größer als die der positiven, wenn die Zelle mehr als zwei Platten enthält; die erste, dritte usw. letzte Platte ist negativ. Ist also die Kapazität pro Quadratdezimeter projizierter Oberfläche bei der negativen Platte die gleiche wie bei der positiven, so ist die Gesamtkapazität der negativen etwas größer als diejenige der positiven. Im Laufe der Zeit vergrößert sich, wie später gezeigt wird, die Kapazität der Positiven im Vergleich zu derjenigen der Negativen. Durch die angedeutete Anordnung wird also verhindert, daß die gesamte Kapazität der Positiven von derjenigen der Negativen später stark verschieden ist. Positive Platten werden auch aus dem Grunde nicht als Endplatten benutzt, weil sie, einseitig beansprucht, sich krümmen.
Die Kapazität eines gegebenen Akkumulators hängt in hohem Maße von der Entladestromstärke ab. Bei der Entladung nämlich wird Säure für[63] die Sulfatbildung verbraucht, so daß stets neue Säure in die Poren der aktiven Masse eindringen muß. Wird nun mit großer Stromdichte entladen, so kann die für den chemischen Umsatz nötige Säure nicht schnell genug in das Innere der Platten eindringen (hineindiffundieren), so daß die elektromotorische Kraft, die ja von der Säuredichte abhängig ist, stark abnimmt, obschon noch größere Mengen von Blei und Bleisuperoxyd vorhanden sind; wenn ferner keine Schwefelsäure mehr in Berührung mit der aktiven Masse ist, so hört der chemische Umsatz, d. h. der stromliefernde Prozeß, auf.
Meines Erachtens spielen hier auch die Volumänderungen, mit denen der chemische Umsatz verbunden ist, eine Rolle. Das aus 1 Gramm Blei oder Bleisuperoxyd entstandene Bleisulfat nimmt einen größeren Raum ein als das Blei oder Bleisuperoxyd. Während der Entladung werden sich daher die vorhandenen Poren verengen und mit Bleisulfat ganz ausfüllen. Wird mit schwachem Strom entladen, so verengt sich die Pore in den verschiedenen Querschnitten nahezu gleichmäßig; bei großer Stromdichte aber wird sie hauptsächlich an der dem Elektrolyten zugewendeten Seite enger oder verstopft sich; die Säurediffusion wird sehr erschwert und hört bald auf. Bei der Ladung verringert sich das Volumen der aktiven Masse, und die Poren erweitern sich. Nach dieser Erklärung müßte die Aufnahmefähigkeit[53] bei der Ladung (Ladungskapazität) weniger von der Stromdichte abhängig sein als die Kapazität bei der Entladung. Die Erfahrung zeigt, daß dies in der Tat der Fall ist.
Ferner muß man schließen, daß die Kapazität der Negativen in höherem Maße von der Entladezeit oder von der Stromdichte bei der Entladung abhängig ist als die Kapazität der Positiven.
Denn der Unterschied im Volumen einer bestimmten Menge (z. B. 3,85 Gramm) Blei und des daraus gebildeten Bleisulfates ist größer als die Differenz des Volumens der äquivalenten Menge Bleisuperoxyd (z. B. 4,46 Gramm) und des aus diesem entstandenen Bleisulfats.
[64]
Durch eingehende Untersuchung gelangt auch E. Sieg zu diesem Resultate (l. c. S. 83), er findet nämlich, „daß die Bleischwammplatten (und zwar Großoberflächen- und gepastete Platten) bei genau gleicher „absoluter‟ Kapazität, d. h. derjenigen Kapazität, die von den Platten geleistet werden kann, wenn die Entladestromstärke sehr klein gewählt wird, gegen Erhöhung der Beanspruchung empfindlicher sind als Superoxydplatten‟. Daraus würde sich dann der Schluß ergeben, daß bei Akkumulatoren, die mit großer Stromdichte entladen werden sollen, die absolute Kapazität der negativen Platten größer zu wählen ist als diejenige der positiven.
Dolezalek folgert aus dem Umstande, daß die Konzentrationsänderungen an der Superoxydelektrode erheblich größer sind als an der Bleischwammelektrode (weil an ersterer auch Wasser gebildet wird), daß die Kapazität der Superoxydelektrode geringer sein muß als die einer aus gleicher Paste formierten Bleischwammplatte (l. c. S. 86). Wenn demnach die Konzentrationsänderungen allein maßgebend wären, so müßte die positive Platte die empfindlichere sein.
Man kann weiter schließen, daß die Kapazität von der Porosität der aktiven Masse abhängig sein wird, besonders bei Entladungen mit großer Stromdichte. Auch die Dicke der Schicht, in der sich der chemische Umsatz vollzieht, spielt eine Rolle.
Da ferner bei der Ladung die Substanzen gebildet werden, die sich bei der Entladung in Bleisulfat umwandeln, so ist es selbstverständlich, daß die Art der vorhergegangenen Ladung auf die Kapazität einen Einfluß ausübt. Je geringer die Stromdichte bei dieser Ladung war, um so mehr Bleischwamm ist auf der negativen Platte vorhanden und um so mehr PbO2 auf der positiven.
Bei stationären Akkumulatoren (Beleuchtungsanlagen) geht man in der Regel nicht unter dreistündige Entladezeit herab. Nennt man die Kapazität bei dreistündiger Entladung c3 und die bei zehnstündiger c10, so gilt meistens mit großer Annäherung die Beziehung c3 : c10 = 26:35 oder ungefähr = 3:4.
[65]
Schröder[54] gelangte auf Grund von Untersuchungen an Akkumulatoren der Akkum.-Fabrik Akt.-Ges. Hagen i. W. zu der Formel
K · ∛J2 = m,
wo K die Kapazität in Amperstunden, J die Entladestromstärke und m eine für den betreffenden Akkumulator charakteristische Konstante ist. Für die meistens in der Praxis vorkommenden Intervalle von J liefert die Formel hinreichend genaue Werte. — C. Liebenow fand, daß für schwache Entladungen
K = m1 + c . J
(m und c sind Konstante).
Nach Peukert[55] ist
Jn.t = const.,
wo J die Entladestromstärke, t die Entladedauer, n einen durch das Experiment zu bestimmenden Faktor bedeutet; n lag bei den untersuchten Typen zwischen 1,35 und 1,72.
Die gesamte Elektrizitätsmenge, die man einem Akkumulator entnehmen kann, ist, um es noch einmal zu wiederholen, durch das Gewicht des vorhandenen bezw. zugänglichen Bleischwammes und Bleisuperoxydes gegeben. Soll beispielsweise ein Akkumulator bei 10stündiger Entladung 100 Amperstunden abgeben, so müssen auf der negativen Elektrode mindestens 385 Gramm Bleischwamm und auf der positiven mindestens 446 Gramm Bleisuperoxyd angehäuft sein (siehe S. 37). In Wirklichkeit müssen aber größere Mengen der wirksamen Massen vorhanden sein, da auch bei 10stündiger Entladung nicht alles Pb und nicht alles PbO2 umgewandelt wird.
Eine vollständige Ausnutzung des vorhandenen aktiven Materials ist sogar theoretisch nicht möglich, weil PbSO4 ein sehr schlechter Leiter ist. Nach Roloff werden bei 3stündiger Entladung[66] bei den Positiven 45%, bei den Negativen 25% der anfänglich vorhandenen aktiven Masse ausgenutzt.
Natürlich mußten dem Akkumulator, wenn er 100 Amperstunden abgeben soll, bei der vorhergegangenen Ladung mindestens 100 Amperstunden zugeführt worden sein. Es ist allerdings denkbar, daß ein Akkumulator ein Mal mehr Elektrizität abgibt, als man bei der Ladung in ihn hineingeschickt hat, indem nämlich Blei und Bleisuperoxyd, das bei der vorletzten Entladung nicht in Bleisulfat verwandelt wurde, jetzt verbraucht wird.
Da die Abhängigkeit der Kapazität von der Entladezeit im engsten Zusammenhange mit den Diffusionsvorgängen steht, so kann man voraussagen, daß die Änderungen für die verschiedenen Systeme nicht die gleichen sind; bei Großoberflächenplatten (s. Kap. 6) wird diese Abhängigkeit nicht so groß sein, wie bei pastierten Platten.
Außer von der Entladestromstärke hängt die Kapazität von der Dicke der aktiven Schicht, der Säuredichte und von der Temperatur ab. Ist das Bleisuperoxyd und ebenso der Bleischwamm als sehr dünner Überzug auf einer großen Oberfläche verteilt, so kann die für die Bleisulfatbildung nötige Säure leichter in das Innere eindringen, als wenn die wirksame Masse eine dickere Schicht mit kleinerer Oberfläche bildet.
Der Forderung möglichst dünne Platten zu Verwenden, stehen folgende Bedenken im Wege: Die Lebensdauer der Platten verringert sich, die Platten müssen eine gewisse mechanische Festigkeit haben, bei sehr dünnen Platten ist nicht genügend Raum für die Aufnahme der Paste vorhanden, der Widerstand der Platten wird größer.
Die Abhängigkeit der Kapazität von der Säuredichte hat zuerst Heim[56] näher untersucht.[67] Er fand, daß die Kapazität, wenn man die Säuredichte vergrößert, zuerst steigt und dann wieder abnimmt; das Maximum lag bei einem spezifischen Gewichte von 1,1. Nach Earle ist die Kapazität am größten, wenn die Säuredichte etwa gleich 1,25 ist. Da bei dieser Dichte verdünnte Schwefelsäure (genauer bei 1,22) das Maximum der Leitfähigkeit besitzt, so darf man die Kapazität als eine Funktion des Leitungsvermögens des Elektrolyten ansehen, ein Schluß, der mit unseren früheren Überlegungen in Einklang steht. Die Stromlinien dringen eben um so tiefer in das Innere der aktiven Masse ein, die Umwandlung in Bleisulfat ist um so vollständiger, je besser die Säure leitet.
Der Einfluß der Temperatur auf die Kapazität ist ein nicht unerheblicher. Durch Messungen von Heim[57] ergab sich, daß die Kapazität pro 1° Temperaturerhöhung innerhalb der Grenzen 14° und 45° um 2,6% des der Temperatur 19° entsprechenden Betrages stieg. Die Zunahme der Kapazität mit der Temperatur kann durch den rascheren Ausgleich der Konzentrationsänderungen (infolge größerer Beweglichkeit der Säure), sowie durch die Zunahme des Leitungsvermögens des Elektrolyten[58] erklärt werden. In der Praxis kann man von der Kapazitätssteigerung durch Erwärmung der Säure schon aus dem Grunde keinen Gebrauch machen, weil sie eine vorzeitige Abnutzung der Platten zur Folge hat.
Zu bemerken ist noch, daß bei einem Akkumulator, der mit Ruhepausen entladen wird, die Kapazität eine andere ist, als bei einem Elemente, das mit gleicher Stromstärke ohne Unterbrechung beansprucht wird;[68] sind die Ruhepausen nicht so groß, daß die Selbstentladung während derselben merkliche Verluste verursacht (siehe S. 106), so ist die Kapazität im ersteren Falle die größere.
B. Albrecht fand, daß bei Akkumulatoren mit positiven Großoberflächenplatten (s. Kap. 6) eine merkliche Zunahme der Kapazität infolge der Ruhepausen nicht stattfand. Wahrscheinlich ist dieser Umstand der Selbstentladung während der Ruhepausen zuzuschreiben. Bei den Masseplatten wurde eine ganz bedeutende Zunahme der Kapazität infolge der Unterbrechungen beobachtet, und zwar ist die prozentuale Zunahme um so bedeutender, je größer die Entladestromstärke ist. Die Untersuchungen wurden allerdings nur mit Platten einer Firma ausgeführt. (Näheres s. E. T. Z. 1907, S. 539.)
Die Kapazität eines Akkumulators ändert sich im Laufe der Zeit. In der Regel nimmt sie zuerst zu, erreicht ein Maximum und sinkt dann. Hierbei ist zu beachten, daß verschiedene Fabriken die Platten in nicht fertig formiertem Zustande liefern, so daß in der ersten Zeit die Formation fortschreitet und die Aufnahmefähigkeit steigt. Auch bei Platten, die soweit als möglich in der Fabrik formiert wurden, kann die Kapazität wachsen; es gilt dies besonders von positiven Großoberflächenplatten (s. Planté-Formation). Andererseits kann die Kapazität im Gebrauche geringer werden, weil aktive Masse aus dem Gitter herausfällt oder abbröckelt.
Wenn man zwischen Kohlenelektroden verdünnte Schwefelsäure elektrolysiert, so findet man nach einiger Zeit auf dem Boden zahlreiche kleine Kohlenpartikelchen. Diese werden von den Gasblasen gleichsam abgerieben oder losgesprengt.
Über die Kapazitätsabnahme infolge der Verbleiung siehe Kap. 7. Auch die Sulfatation hat einen Rückgang der Kapazität zur Folge (s. Kap. 5).
Die Beschaffenheit der Elektroden übt, wie P. Schoop[59] sagt, einen schwer kontrollierbaren Einfluß[69] auf die Kapazität aus. Ist eine Batterie längere Zeit nicht benutzt worden, so ist die Kapazität geringer. Durch mehrmaliges Laden und Entladen muß man dann die Platten auffrischen.
Eine Kapazitätsprobe wird bei der Abnahme einer gelieferten Batterie ausgeführt; auch empfiehlt es sich, eine solche vorzunehmen, wenn man über den Zustand der Batterie im Zweifel ist, besonders wenn sie längere Zeit nicht benutzt worden ist. Die Prüfung geschieht folgendermaßen: Die Batterie wird mit normaler Stromstärke (etwa der der fünfstündigen Ladung entsprechenden) geladen; kurze Zeit nach der Ladung soll die Entladung beginnen. Man reguliert die Stromstärke so, daß sie den für die betreffende Entladezeit (z. B. fünf Stunden) vorgeschriebenen Wert hat und hält sie tunlichst konstant. Kann man den Strom nicht ausnutzen (z. B. für den Betrieb von Motoren, oder für elektrolytische Zwecke), so schaltet man die Batterie auf einen regulierbaren Metall- oder Wasserwiderstand (der Gebrauch des letzteren ist ziemlich unbequem wegen der Schaumbildung, des Siedens der Flüssigkeit usw.). Am einfachsten bestimmt man die abgegebene Elektrizitätsmenge mittels eines Coulomb- oder Amperstundenzählers; benutzt man hierfür ein Amperemeter, so muß man in Zeitabschnitten von 10-15 Minuten die Stromstärke ablesen. Durch ein mit den Klemmen der Batterie verbundenes Voltmeter wird die Spannung gemessen. Der Versuch ist natürlich abzubrechen, wenn die untere Spannungsgrenze erreicht ist, d. h. wenn die Klemmenspannung um etwa 10% der anfänglichen gesunken ist. — Aus früheren Betrachtungen ergibt sich übrigens, daß man durch eine einmalige Entladung ein zuverlässiges Resultat nicht erhalten kann.
[70]
Hat man gefunden, daß die Kapazität eines Akkumulators zurückgegangen ist, so ist es von Wichtigkeit zu wissen, ob die Ursache an der positiven oder an der negativen Elektrode liegt. Um dies zu prüfen, bedient man sich der Fuchsschen Methode; das Verdienst, diese in die Akkumulatorentechnik eingeführt zu haben, gebührt C. Liebenow[60]. Man bedient sich bei dieser Methode einer sogen. Hilfselektrode, am einfachsten eines amalgamierten Zinkstäbchens oder am besten eines Kadmiumblechs; die Meßelektrode[61] taucht man so in die Säure ein, daß sie von möglichst wenig Stromfäden getroffen wird. Sie bildet in verdünnter Schwefelsäure sowohl mit Bleisuperoxyd als auch mit dem Bleischwamm ein galvanisches Element. Die elektromotorischen Kräfte e1 und e2 betragen bei der gewöhnlichen Säuredichte bei Beginn der Entladung
| für | Zink | und | Bleisuperoxyd | 2,41 | Volt | , | |
| „ | „ | „ | Bleischwamm | 0,40 | „ | , | |
| „ | Kadmium | „ | Bleisuperoxyd | 2,17 | „ | , | |
| „ | „ | „ | Blei | 0,16 | „ | . | |
e1 - e2 ist, wenn die Zelle keinen Strom abgibt, mit großer Annäherung die elektromotorische Kraft des Akkumulators. Entnimmt man der Zelle Strom, so ändern sich e1 und e2 etwas, und es ist jetzt ihre Differenz gleich der Klemmenspannung, wenn der[71] innere Widerstand des Elementes so klein ist, daß man das Produkt i · w vernachlässigen kann.
Man macht während der Entladung eine größere Reihe von Messungen und trägt die Werte von e1 und e2 sowie diejenigen für die Klemmenspannung auf Millimeterpapier nach der Zeit auf, d. h. man macht die Zeit zu Abszissen und die Spannungen zu Ordinaten. Man erhält so drei Kurven, die den Verlauf der Klemmenspannung und der elektromotorischen Kräfte der beiden Kombinationen
| Hilfselektrode | verdünnte Schwefelsäure | Bleisuperoxyd |
| „ | „ | Bleischwamm |
anzeigen. Die elektromotorischen Kräfte e1 und e2 müssen sich bei fortschreitender Entladung einander allmählich nähern, da die positive und die negative Platte einander ähnlich werden. Bei gleicher Kapazität der beiden Platten müssen offenbar die Kurven zur selben Zeit, nämlich wenn die Klemmenspannung anfängt abzufallen, stark umbiegen, die eine nach unten, die andere nach oben.
Nach Sieg sind die positiven Platten entladen, sobald sie gegen Kadmium unter 2 Volt anzeigen, die negativen, sobald sie gegen Kadmium über 0,2 Volt haben.
Liebenow gelangt auf Grund seiner Beobachtungen zu der Regel, daß die Fuchssche Methode dann eindeutige Resultate gibt, wenn sie klar eine wesentliche Verschiedenheit der Kapazität beider Plattensorten anzeigt. Wenden sich dagegen die beiden Kurven (e1 und e2) beim Herabgehen der Klemmenspannung gleichzeitig, so können positive und negative Platten die gleiche Kapazität haben, es kann aber auch die der einen kleiner sein als die der anderen.
[72]
Wirkungsgrad[62]. Nennt man die einem Elemente während der Ladung zugeführte Elektrizitätsmenge, ausgedrückt in Amperstunden (oder in Coulomb), Q1 und die während der Entladung von der Zelle abgegebene Elektrizitätsmenge Q2, so ist
Q2Q1 der Wirkungsgrad.
Multipliziert man den erhaltenen Bruch mit 100, so erhält man den Wirkungsgrad in Prozenten der hineingeladenen Elektrizitätsmenge.
Da Q1 und Q2 von der Stromdichte, also auch von der Dauer der Ladung und Entladung, abhängig sind, so empfiehlt es sich, mit derselben Stromdichte zu entladen, mit der geladen wurde (s. Kapazität).
Der Wirkungsgrad beträgt aus verschiedenen Gründen weniger als 100% (in der Praxis nimmt man 85-90% an). Stromverluste, die man bei Laboratoriumsversuchen auf 3-4% herunterdrücken kann, werden zum Teil durch eine schwache während der ganzen Ladung erfolgende Gasbildung verursacht. Je größer die Stromdichte bei der Ladung ist, um so größer ist die durchschnittliche Klemmenspannung, um so größer wird also auch der Bruchteil des Stromes, der für die Gasbildung nutzlos verwertet wird. Besonders während der „Überladung‟ (Ladung nach Beginn des „Kochens‟) werden größere Elektrizitätsmengen für die Abscheidung von Wasserstoff und Sauerstoff verbraucht, die bei der Entladung nicht wiedergewonnen werden. Bei einer Wirkungsgradbestimmung wird man daher von einer Überladung absehen.
[73]
Kleine Verluste können auch dadurch verursacht werden, daß während der Ladung Teilchen der aktiven Masse durch die Gase abgekratzt oder losgesprengt werden.
Läßt man das Element nach erfolgter Ladung unbenutzt stehen, so erfolgt Selbstentladung, die eine Verringerung von Q2 zur Folge hat. Je länger also die zwischen Ladung und Entladung liegende Zeit ist, um so geringer wird der Wirkungsgrad.
Nutzeffekt[63]. Man versteht darunter den Quotienten, den man erhält, wenn man die vom Akkumulator während der Entladung abgegebene Energie (gemessen in Wattstunden) durch die dem Akkumulator bei der vorhergegangenen Ladung zugeführte Energie (in Wattstunden) dividiert. Beispiel: Eine Zelle wurde mit 50 Amper 4 Stunden lang geladen; die mittlere Ladespannung war 2,3 Volt; die dem Akkumulator zugeführte Energie w1 betrug
w1 = 2,3 . 50.4 Wattstdn. = 460 Wattstdn.
Die Zelle wurde etwa 1⁄2 Stunde nach der Ladung mit 50 Amp. entladen; nach ungefähr 33⁄4 Stunden war die Spannung auf 1,8 Volt gesunken. Da die mittlere Spannung, wie die Messungen ergaben, jetzt rund 1,9 Volt betrug, so belief sich die vom Akkumulator abgegebene Leistung w2 auf
w2 = 50 . 3,75 . 1,9 Wattstdn. = 356,25 Wattstdn.
Mithin war in diesem Falle der Nutzeffekt gleich
w2w1 = 356,25460 = 0,77 oder 77%.
Im Laboratorium kann man, wenn man mit geringer Stromdichte lädt und entlädt, einen Nutzeffekt von 90%[74] und noch mehr erzielen. Mit zunehmender Entladestromstärke nimmt der Quotient ab. In der Praxis rechnet man mit einem Nutzeffekte von 70-75%. [Auf die Rolle, die die zwischen Ladung und Entladung liegende Zeit spielt, ist schon aufmerksam gemacht worden.]
Man könnte der Ansicht sein, daß der Nutzeffekt deshalb mit wachsender Entladestromstärke sinkt, weil bei größerer Stromdichte der innere Widerstand des Akkumulators zunimmt. Daß sich dieser mit der Stromstärke und mit der Dauer der Zufuhr bezw. Entnahme von Elektrizität etwas ändert, soll später nachgewiesen werden. Einstweilen begnügen wir uns mit der Bemerkung, daß der innere Widerstand auch kleiner Zellen in den verschiedenen Stadien der Ladung und Entladung und daher auch der Spannungsverlust im Elemente (i · w) so klein ist, daß durch ihn der Nutzeffekt nur in geringem Maße beeinflußt wird. Die Gründe, weshalb der Nutzeffekt weit unter 100% liegt, sind schon früher dargelegt worden; diese sind die Konzentrationsänderungen und die Abhängigkeit der elektromotorischen Kraft von der Säuredichte.
Daß durch die Konzentrationsänderungen, die sich sowohl bei der Ladung wie bei der Entladung vollziehen, Arbeitsverluste verursacht werden, kann man sich auch folgendermaßen klar machen. Wenn man zwei Schwefelsäurelösungen verschiedener Konzentration mischt, so wird Wärme frei; sollen umgekehrt die beiden miteinander vermischten Säuren getrennt, soll also ein Konzentrationsunterschied hergestellt werden, so muß Arbeit aufgewendet werden. Da nun im Akkumulator durch den Strom ein Konzentrationsunterschied hergestellt und aufrecht erhalten wird, so muß hierfür elektrische Energie verbraucht werden. Dolezalek leitet eine Formel für die betreffenden Energieverluste ab, aus der sich ergibt, daß der Nutzeffekt abhängig ist von dem mechanischen Bau (Porosität) der Platten, von der Leitfähigkeit der Plattensäure, von der Stromstärke und von der Zeit. Beachtenswert ist, daß diese Energieverluste, ebenso wie die der[75] Jouleschen Wärme entsprechenden der Leitfähigkeit der Säure umgekehrt proportional sind. Da nun Säure vom spezifischen Gewicht 1,22 (ca. 30% Schwefelsäure) das Maximum der Leitfähigkeit besitzt, so ist der Nutzeffekt bei dieser Säuredichte am größten.
Die Arbeitsverluste kann man graphisch bestimmen, wenn man die Lade- und Entladekurve aufgenommen hat. Wählt man nämlich für die beiden Kurven dieselben Koordinatenachsen (Zeiten als Abszissen, Spannungen als Ordinaten), so schließen dieselben eine Fläche ein, die ein Maß für die Energieverluste ist. Um dies zu beweisen, denken wir uns die Zeit in Abschnitte t1, t2 ... zerlegt, die so klein sind, daß man von der Änderung der Spannung während eines jeden Intervalls absehen kann. Nennen wir die zugehörigen Spannungen bei der Ladung E1, E2 ..., bei der Entladung e1, e2 ..., und bezeichnen wir die (konstante) Stromstärke, die bei der Ladung und Entladung die gleiche sein muß, mit J, so ist die
| Ladearbeit | während | der | Zeit | t1 | gleich | E1 · J · t1, |
| „ | „ | „ | „ | t2 | „ | E2 · J · t2 ... |
| Entladearbeit | „ | „ | „ | t1 | „ | e1 · J · t1, |
| „ | „ | „ | „ | t2 | „ | e2 · J · t2 ... |
Der Energieverlust in der Zeit t1 ist mithin (E1 - e1) · J · t1 oder proportional (E1 - e1) · t1. Durch dieses Produkt wird aber das der Zeit t1 entsprechende Stück der zwischen den beiden Kurven liegenden Fläche dargestellt usw.
Der innere Widerstand eines Akkumulators, der bei Pufferbatterien (s. Kap. 9) eine wichtige Rolle spielt, kann in drei Summanden zerlegt werden, nämlich in den Widerstand, den der Strom in den verschiedenen Teilen der positiven Platte (bezw. Platten) findet (wp), denjenigen in der negativen Elektrode (wn) und den [76]Widerstand in der Säure zwischen den Elektroden (ws). Zu wp und wn ist auch derjenige Widerstand zu rechnen, den die Elektrizität in der in den Poren befindlichen Säure findet. Diese beiden Summanden, die unter sonst gleichen Umständen bei Planté-Platten einen anderen Wert haben als bei Faure-Platten, ändern sich im Laufe der Ladung und Entladung. Je mehr Bleisulfat nämlich zwischen den Blei- bezw. Bleisuperoxydpartikelchen verteilt ist, um so größer werden wp und wn; ferner steigt bezw. sinkt die Konzentration der Säure in den Poren; endlich hat die Erzeugung von Joulescher Wärme eine Temperaturerhöhung zur Folge. Auch mit dem Alter der Platten ändern sich die beiden Widerstände (s. Lebensdauer).
ws ist ebenfalls variabel, da die Dichte der Säure zwischen den Platten (der „äußeren‟ Säure) während der Ladung zunimmt und bei der Entladung sinkt; dies gilt besonders von denjenigen Schichten der Säure, die an die Oberflächen der Platten grenzen; auch können Gase, die sich gegen Ende der Entladung entwickeln, eine Vergrößerung von ws verursachen.
Die Leitfähigkeit einer Schwefelsäurelösung ändert sich mit dem spezifischen Gewichte. Setzt man einer bestimmten Menge Wasser Schwefelsäure in kleineren Quantitäten nach und nach zu, so findet man, daß das Leitungsvermögen zuerst schnell, dann langsam wächst, später aber wieder abnimmt; bei einer Säuredichte von 1,224 ist das Leitungsvermögen ein Maximum. Die betreffende Lösung enthält etwa 30,5 Gewichtsprozente Schwefelsäure; der spezifische Widerstand (Widerstand pro cm3) beträgt etwa 1,35 Ohm[64].
[77]
Der Widerstand eines Akkumulators im stromlosen Zustande kann wie derjenige eines jeden anderen elektrolytischen Apparates bestimmt werden. Bei der einfachen Brückenschaltung mit den von F. Kohlrausch angegebenen Modifikationen (Wechselströme, Telephon) erhält man besonders bei größeren Zellen (bei solchen ist der Widerstand kaum ein Tausendstel Ohm groß) wegen der Übergangswiderstände an den Klemmen keine genauen Resultate. Diese werden bei der Brückenschaltung von Matthiesen und Hockin eliminiert.
Angenähert (der Größenordnung nach) kann man den inneren Widerstand folgendermaßen bestimmen. Man lädt das Element, dessen Widerstand man ermitteln will, aus zwei hintereinander geschalteten Akkumulatoren unter Einschaltung eines Kurbelrheostats. Die Klemmen der Ladebatterie seien k1 und k2, die daran befestigten Drähte d1 und d2. Legt man d1 und d2 an k1 (oder an k2), so gibt das zu untersuchende Element Strom ab. Dieser Strom ist bei Beginn der Ladung nur wenig verschieden von dem Ladestrom. Bei einiger Übung kann man innerhalb eines Zeitraumes von einigen Sekunden laden, umschalten (also entladen) und die nötigen Ablesungen an einem mit den Klemmen des Elementes verbundenen Voltmeter vornehmen. Während der Ladung ist
e = E + i · w
(e = Klemmenspannung, E = elektromotorische Kraft der Zelle)
und während der Entladung ist
e′ = E - i · w.
Die Differenz der beiden Klemmenspannungen ist also (angenähert) gleich 2wi.
Wenn die elektromotorische Kraft eines Akkumulators konstant wäre, so könnte man w leicht während der Ladung und Entladung bestimmen; denn dann wäre
w = e - Ei.
Es würde genügen, „den Stromkreis für kurze Zeit zu öffnen‟ und die Spannung, die das mit den[78] Klemmen verbundene aperiodische Voltmeter anzeigt (E), abzulesen. Wie jedoch aus den Kurven im folgenden Kapitel hervorgeht, gehen die Änderungen der elektromotorischen Kraft schnell vor sich, so daß die Unterbrechungsmethode sehr unzuverlässig ist. Will man den Widerstand einer Zelle während des Stromdurchganges genau bestimmen, so kann man die Methode von Uppenborn[65] oder die von Nernst und Haagn angegebene benutzen. Letztere unterscheidet sich von der gewöhnlichen Brückenmethode dadurch, daß zwei Widerstände durch Kondensatoren ersetzt sind, außerdem wird noch ein Hilfskondensator eingeschaltet, der verhindert, daß die Zelle Strom in die Brückenanordnung sendet[66]. (Eine ausführliche Beschreibung der verschiedenen Meßmethoden findet man in dem bekannten Werke von F. Kohlrausch, Leitfaden der Physik.)
Nach Messungen von Haagn stieg der Widerstand einer kleinen Zelle während der etwa fünfstündigen Entladung von 0,018 bis 0,045 Ohm, während der Ladung fiel er von 0,04 auf 0,018 Ohm. Nach Messungen von Häberlein verhält sich der Widerstand bei Beginn zu demjenigen am Ende der Ladung wie 17:24. Roloff gibt für die Type 3 × J1 der Akkumulatoren-Fabrik Akt.-Ges. an, daß der Widerstand bei Beginn der Entladung 0,0012 Ohm und am Ende 0,0018 Ohm war.
Da die Konzentration der Säure in den Poren der wirksamen Masse von der Stromdichte abhängig ist, so folgt erstens, daß bei schneller Entladung (großer Stromdichte) der durchschnittliche (mittlere) Widerstand größer ist als bei langsamer Entladung und zweitens, daß der Spannungsabfall im Elemente (w · J) nicht linear mit der Stromdichte wächst, sondern in einem etwas stärkeren Verhältnisse.
[79]
Wenn man Zellen von verschiedener Kapazität, die aus Platten von derselben Konstruktion zusammengesetzt sind und Säure von derselben Dichte enthalten, mit gleicher Stromdichte beansprucht, so darf man das Produkt w · J als konstant ansehen; denn in dem Maße, in dem w bei den großen Zellen abnimmt, wächst J.
[52] Wenn man zwischen Platin- oder Kohlenelektroden verdünnte Schwefelsäure zersetzt, so steigen an den Außenseiten der Elektroden nur wenige Gasblasen empor. Bei der Ladung eines Akkumulators wird dementsprechend an der Außenseite der positiven und negativen Elektrode nur wenig Bleisuperoxyd bezw. Blei gebildet.
[53] Diese müßte eigentlich als „Kapazität‟ schlechthin bezeichnet werden.
[54] E. T. Z. 1904, S. 587.
[55] E. T. Z. 1897, S. 287.
[56] E. T. Z. 1889, S. 88.
[57] E. T. Z. 1901, S. 811.
[58] Wenn man einen Elektrolyten erwärmt, so wächst das Leitungsvermögen ziemlich stark.
[59] P. Schoop, Die Sekundär-Elemente.
[60] Zeitschr. f. Elektrochemie 1902, Nr. 44.
[61] Liebenow empfiehlt als Meßelektrode eine kleine Zelle aus Ton (porös), in der sich Kadmiumamalgam und eine konzentrierte Lösung von Kadmiumsulfat in Akkumulatorensäure befindet. Ein durch einen Glasstab isolierter Draht geht bis zum Kadmiumamalgam. Man stellt die Zelle auf die Oberkante der Platten; ihr unteres Ende muß dann von der Säure benetzt werden. Die Anordnung entspricht einem Voltaschen Elemente, bei dem eine Elektrode in einer mit verdünnter Schwefelsäure angefüllten Tonzelle steht.
[62] Was hier „Wirkungsgrad‟ genannt wird, wird von anderen Autoren als „Güteverhältnis‟ bezeichnet, während das Verhältnis der entnommenen Energie zu der bei der Ladung aufgewendeten Energie vielfach als Wirkungsgrad bezeichnet wird.
[63] Man vergleiche die Fußnote auf der vorigen Seite.
[64] Man bezieht das Leitvermögen (und den spezifischen Widerstand) der Elektrolyte auf eine Säule von 1 cm Länge und 1 qcm Querschnitt, also kurz auf 1 ccm.
[65] Näheres siehe Uppenborn, Kalender für Elektrotechniker.
[66] Zeitschr. f. Elektrochemie 1897, S. 421.
[80]
Wir wollen zunächst das Verhalten des Bleiakkumulators während der Ladung und Entladung betrachten.
1. Ladung. In den ersten Minuten nach Beginn der Ladung, für die das in Fig. 2 (s. S. 26) gegebene Schaltungsschema gilt, steigt die Klemmenspannung des Akkumulators ziemlich schnell auf 2,1 bis 2,18 Volt[67]. Oft beobachtet man, daß die Spannung im Anfange der Ladung zuerst steigt und dann wieder etwas abfällt, daß also das erste Stück der Spannungskurve einen kleinen Höcker aufweist. Während des größten Teiles der Ladung wächst die Spannung nur ganz langsam bis zu 2,2 Volt; gegen Ende der Ladung erfolgt ein schneller Anstieg der Kurve.
Bei etwa 2,3 Volt beginnt die Gasentwicklung; an den Anoden schon etwas früher; sie ist zuerst schwach, dann lebhaft; der Akkumulator „kocht‟. Die Klemmenspannung hängt besonders während der Gasbildung in hohem Maße von der Ladestromstärke ab (s. Fig. 7); hat der Strom noch den der vierstündigen Ladung entsprechenden[81] Wert, so steigt die Spannung bis zu etwa 2,7 Volt und ev. noch höher.
Fig. 7.
Fig. 8.
In den Fig. 7 und 8 ist der Verlauf der Klemmenspannung bei Beginn und gegen Ende der Ladung[82] graphisch dargestellt. Die Zelle bestand aus 5 Platten, 2 positiven und 3 negativen (10 cm × 14 cm); die ersteren waren Großoberflächenplatten. Die Stromdichte betrug zuerst etwa 0,6, später etwa 0,4 Amp. pro Quadratdezimeter, bezogen auf die positiven Platten.
Die Stromdichte war verhältnismäßig klein. Nach Heim[68] ist bei dreistündiger Entladung die Stromdichte bei positiven Großoberflächenplatten 1,3-1 Amp. pro 1 dm2.
Vereinzelte Gasblasen sieht man während der ganzen Ladung emporsteigen. Die Gase, die sich entwickeln, sind die Elemente des Wassers, und zwar entweicht der Sauerstoff an den positiven, der Wasserstoff an den negativen Platten. Die stärkere Gasentwicklung ist ein Zeichen, daß der chemische Umsatz an den dem Strome zugänglichen Teilen der aktiven Masse nahezu vollendet ist. Hat man den Akkumulator mit der höchsten zulässigen Stromstärke geladen, so setzt man, sobald lebhafte Gasbildung erfolgt, den Strom auf die Hälfte bis ein Drittel seiner bisherigen Stärke herab.
Die Klemmenspannung e während der Ladung kann in zwei Summanden zerlegt werden; der eine Teil dient dazu, die Gegenspannung (die momentane elektromotorische Kraft) des Elementes E aufzuheben, der andere, den Ohmschen Widerstand w der Zelle zu überwinden:
e = E + i · w.
Man beobachtet oft, wie schon erwähnt wurde, daß kurze Zeit nach Beginn der Ladung die Potentialdifferenz der Klemmen etwas sinkt und dann wieder ansteigt. Diese Erscheinung ist nach Dolezalek auf eine Änderung[83] des Widerstandes zurückzuführen, den der Strom in den Platten findet. Während der der Ladung vorausgegangenen Ruhepause bedecken sich die Elektroden wahrscheinlich mit einer sehr dünnen Schicht von schlechtleitendem Bleisulfat (s. Sulfatierung). Dieses wird, wenn die Ladung beginnt, in kurzer Zeit gelöst. Im übrigen wird durch die Änderung des inneren Widerstandes während der Ladung die Klemmenspannung nur wenig beeinflußt. Das anfängliche schnelle und das spätere langsame Wachsen der Klemmenspannung ist auf die Änderung der Konzentration der Säure in den Poren der wirksamen Masse und der äußeren Säure zurückzuführen. Sobald die Stromzufuhr beginnt, wird in den Poren Säure frei, die Konzentration (und damit die elektromotorische Kraft) steigt so lange, bis in jedem Zeitteilchen gerade soviel Säure durch Diffusion nach außen gelangt, wie in den Poren durch den chemischen Umsatz erzeugt wird. Je größer die Ladestromstärke ist, um so größer wird der Unterschied der Konzentration der beiden Säuren, um so größer wird die Klemmenspannung. Die Differenz der beiden Konzentrationen können wir, wenn mit konstanter (nicht zu großer) Stromdichte geladen wird, als konstant ansehen; wächst also die Dichte der äußeren Säure, so nimmt auch diejenige der Säure in den Poren zu.
Gegen Ende der Ladung werden von den Platten Gase absorbiert, man spricht daher von einer „Gaspolarisation‟. Da die Okklusionsfähigkeit des Bleies nur eine geringe ist, so ist es sehr zweifelhaft, ob die Gaspolarisation überhaupt eine Rolle spielt. Übrigens kann man, wie wir gesehen haben, den starken Anstieg der Spannung gegen Ende der Ladung darauf zurückführen, daß der Elektrolyt an Bleisulfat verarmt und daher die Konzentration der Blei- und Bleisuperoxydionen[69][84] eine sehr geringe wird (siehe Theorie von Liebenow).
Verschiedene Firmen schreiben vor, daß die von ihnen gelieferten Akkumulatoren ab und zu nach Beginn der lebhaften Gasentwicklung noch längere Zeit, etwa 2-3 Stunden lang, weiter geladen werden sollen. Der Zweck der Überladung, die im allgemeinen schädlich ist, weil durch die entweichenden Gase Teilchen der aktiven Masse abgerissen werden, die ferner eine nicht unwesentliche Verringerung des Nutzeffektes zur Folge hat, ist ein zweifacher. Es kommt zuweilen vor, daß einzelne Zellen einer Batterie aus irgend einem Grunde gegen die anderen „zurückbleiben‟. Bei diesen Zellen erfolgt die Umwandlung von Bleisulfat in Blei bezw. Bleisuperoxyd langsamer als bei den übrigen Elementen, die sich in normalem Zustande befinden. Während der Überladung geht nun die chemische Umwandlung in den kranken Zellen noch weiter vor sich, so daß ihnen Gelegenheit gegeben wird, sich zu erholen. Ferner werden durch die während der Überladung entweichenden Gasblasen Strömungen in der Säure hervorgerufen (die Säure wird aufgewühlt), die eine Vermischung der unteren, dichteren Schichten mit den oberen, weniger dichten zur Folge haben. Die Konzentrationsverschiebungen kommen dadurch zustande, daß während der Ladung konzentrierte Schwefelsäure zu Boden sinkt. (Die Konzentrationsunterschiede kann man leicht nachweisen, indem man mittels eines Hebers Säure aus den oberen und den unteren Schichten entnimmt und mittels des Aräometers die Dichte mißt.)
[85]
Die Stromdichte darf bei der Ladung einen gewissen oberen Grenzwert nicht überschreiten, weil sonst 1. die Umwandlung nur oder fast ausschließlich an der Oberfläche der Platten vor sich geht (s. Kapazität), 2. die Ladespannung einen zu hohen Wert hat (s. Nutzeffekt) und 3. infolge der schnellen, den chemischen Umsatz begleitenden Volumänderungen sich der Zusammenhang zwischen der aktiven Masse lockern kann (s. auch S. 14, Überschwefelsäure).
Die größte zulässige Stromdichte hängt von der wirksamen Oberfläche, von der Dicke der aktiven Schicht und von der Porosität der Platten ab. Gewöhnlich beträgt der maximale Ladestrom (wie er von den Fabriken angegeben wird) so viel Amper, wie der dritte Teil der Kapazität bei dreistündiger Entladung angibt. Ist z. B. die Kapazität bei dreistündiger Entladung 120 Amperstunden, so ist die maximale Ladestromstärke gleich 40 Amp.
Kennt man die maximale Ladestromstärke nicht, so bestimme man die projizierte Oberfläche der Positiven; ist die Länge einer Platte a cm, die Breite b cm, so ist die Oberfläche einer Platte 2 a b cm2; pro Quadratdezimeter darf man 0,6 bis 0,7 Amp. rechnen.
Eine untere Grenze für die Ladestromstärke gibt es nicht; im Gegenteil, je kleiner die Stromstärke, um so günstiger die Ökonomie, um so gründlicher erfolgt der chemische Umsatz. Besonders wenn Zellen zu sehr in Anspruch genommen wurden, oder einige Zeit in entladenem Zustande gestanden haben, ist ihnen eine Ladung mit schwachem Strome von Nutzen.
Über die Ladung von Akkumulatoren bei konstanter Spannung hat Heim[70] eingehende Versuche ausgeführt.
[86]
Einer Reihe von Ladungen mit (angenähert) konstanter Stromstärke, wie sie für drei- bis vierstündige Ladung vorgeschrieben ist, d. h. von normalen Ladungen, folgten Ladungen mit konstanter Spannung von 2,4 Volt, später von 2,5 Volt pro Zelle. Hierbei ist die anfängliche Stromstärke eine verhältnismäßig sehr große, sie sinkt aber schnell. Die Zellen nehmen in jedem Augenblicke diejenige Elektrizitätsmenge auf, die ihrem momentanen Ladezustande angemessen ist; bei Beginn der Ladung ist die Aufnahmefähigkeit der Zelle eine sehr große. Es ergab sich, daß „der Nutzeffekt beim Laden mit konstanter Spannung von 2,4 bis 2,5 Volt und einer Ladezeit von etwa 1⁄2 Stunde nicht sehr wesentlich ungünstiger ausfällt, als man ihn bei 31⁄2- bis 4stündigen Ladungen und 3stündigen Entladungen mit konstantem Strome erzielt‟. Ferner fand Heim, daß durch eine 11⁄2stündige Ladung bei konstanter Spannung von 2,4 Volt die Zellen nicht ganz, bei 2,5 Volt dagegen fast so weit geladen werden, wie durch 31⁄2stündige Ladungen mit konstanter Stromstärke. Durch 1⁄2stündige Ladung bei 2,4 Volt erreicht man die Hälfte, durch 1⁄2stündiges Laden mit 2,5 Volt zwei Drittel der beim Laden mit konstanter Stromstärke erzielten Kapazität. Der Wirkungsgrad in Amperstunden war fast so günstig wie bei der Ladung mit konstanter Stromstärke.
Von der Ladung mit konstanter Spannung wird man aber nur in Ausnahmefällen Gebrauch machen, wohl nur dann, wenn die Zeit, die für die Ladung zur Verfügung steht, knapp bemessen ist, da ihrer Anwendung die schnellere Abnutzung der Platten und vielfach auch der hohe Betrag der anfänglichen Stromstärke im Wege steht. War doch die Stromstärke bei Beginn der Ladung mit 2,5 Volt 6-7 Mal größer als[87] der höchste zulässige Ladestrom[71] und zwar bei einer Type „für starke Entladung‟.
2. Wir wollen uns jetzt mit den verschiedenen Stromquellen beschäftigen, die für die Ladung von Akkumulatoren in Betracht kommen.
Am einfachsten gestaltet sich die Ladung, wenn vorhanden ist ein a) Anschluß an ein Gleichstromnetz. Da die positive Leitung an den positiven Pol der Batterie anzuschließen ist, so muß man in zweifelhaften Fällen zunächst die Polarität der Leitungen bestimmen. Am einfachsten benutzt man die elektrochemische Methode: Man kann z. B. einen Wasserzersetzungsapparat mit den Drähten des Netzes verbinden, wobei eventuell durch einen Vorschaltwiderstand der Strom abzuschwächen ist; diejenige Elektrode, an der die Gasentwickelung am stürmischsten erfolgt, ist mit der negativen Leitung verbunden. Vielfach benutzt man für die Bestimmung der Polarität Polreagenzpapier[72]. Dieses wird vor dem Gebrauche mit Wasser angefeuchtet und auf eine isolierende Unterlage (die Tischplatte) gelegt. Die Enden der Drähte, deren Polarität man bestimmen will, drückt man gegen das Papier; dieses färbt sich, wenn es mit der Lösung eines Alkalisalzes (+ Phenolphtaleïn) imprägniert ist, an derjenigen Stelle, wo es von dem negativen Leitungsdrahte berührt wird, rot.
Ob man bei der Ladung alle Zellen hintereinanderschaltet oder gruppenweise (z. B. die Hälfte) hintereinander und die Gruppen parallel schaltet, hängt von der zur Verfügung stehenden Netzspannung ab. Beträgt[88] z. B. die Netzspannung 110 Volt, und rechnen wir als Endspannung jeder Zelle 2,7 Volt, so kann man 1102,7 = 41 Zellen in Hintereinanderschaltung laden. Soll eine größere Anzahl von Zellen geladen werden, handelt es sich beispielsweise um 80 Zellen, so werden je 40 Zellen in Reihe geschaltet; wir erhalten dann vier freie Pole, zwei positive und zwei negative. Man verbindet nun die beiden positiven Pole durch einen Draht miteinander und ebenso die beiden negativen; an die beiden Verbindungsdrähte wird die Netzleitung angeschlossen (siehe auch S. 97).
In den Ladestromkreis schaltet man ein Ampermeter und einen veränderlichen Widerstand ein. Je größer die Spannung des Netzes und je kleiner die Anzahl der zu ladenden Zellen ist, um so größer muß der Rheostat sein.
Beispiel: Netzspannung 110 Volt, Anzahl der Zellen 20, Ladestromstärke 15 Amper. Da die Spannung jeder Zelle bei Beginn der Ladung rund 2 Volt beträgt, so müssen in dem Vorschaltwiderstand 110 - 40 = 70 Volt erdrosselt werden. Der Spannungsabfall in einem Widerstande von w Ohm beträgt aber, wenn ein Strom von i Amper durch den Widerstand fließt, w · i Volt. Mithin muß der Vorschaltwiderstand 7015 = 4,7 Ohm haben. Ist er etwas kleiner, so schadet das weiter nichts, da die Gegenspannung jeder Zelle in ganz kurzer Zeit auf 2,1 Volt steigt. —
Will man mit konstanter Stromstärke laden, so muß man von Zeit zu Zeit einen Teil des Vorschaltwiderstandes abschalten[73].
Wenn nur wenige Zellen geladen werden sollen und die Netzspannung hoch ist, so kann man statt eines Kurbelrheostates Glühlampen als Vorschaltwiderstand[89] benutzen (Lampenwiderstand). 16kerzige Lampen für 110 Volt verbrauchen rund 0,5 Amper, haben also bei normalem Stromdurchgang einen Widerstand von etwa 220 Ohm (der Widerstand des Kohlefadens nimmt mit steigender Temperatur ab). Schaltet man n solcher Lampen parallel, so entsprechen diese einem Widerstand von 220n Ohm; je größer man also n macht, um so stärker wird der Ladestrom. Das Schaltungsschema ist in Fig. 9 dargestellt: L1 und L2 sind die Drähte der Starkstromleitung, L.W. ist der Lampenwiderstand, B die Batterie.
Fig. 9.
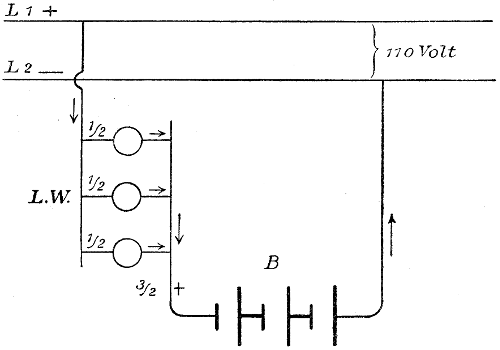
Handelt es sich um die Ladung einer kleinen Anzahl von Zellen, so ist die Stromentnahme aus einem Netze höherer Spannung nicht ökonomisch, da der größte Teil der entnommenen Energie in dem Vorschaltwiderstand nutzlos in Wärme umgesetzt wird.
b) Anschluß an ein Wechselstromnetz. Wechselstrom kann man für die Ladung einer Batterie nicht verwenden. Es muß also entweder eine Umformung in Gleichstrom erfolgen, oder es muß die eine[90] Hälfte einer jeden Stromwelle unterdrückt bezw. stark geschwächt werden.
Die Umformung erfolgt entweder in einem Motorgenerator (Motordynamo) oder in einem Einanker-Umformer (auch rotierender Umformer genannt). Ersterer besteht aus einem Wechselstrommotor und einer von diesem angetriebenen Gleichstrommaschine, letzterer ist eine Dynamomaschine, deren Anker auf der einen Seite mit Schleifringen, auf der anderen mit einem Kommutator (Kollektor) versehen ist. Die Benutzung eines Motorgenerators gewährt den Vorteil, daß man die Spannung der Gleichstrommaschine in einfacher Weise regulieren kann, während eine Änderung der Gleichstromspannung bei einem rotierenden Umformer zwar möglich, aber ziemlich kompliziert ist. Es ist nämlich das Verhältnis zwischen der eingeleiteten Wechselspannung und der von den Bürsten abgenommenen Gleichstromspannung ein festes[74], und zwar geben theoretisch bei Einphasenstrom-Gleichstromumformern 100 Volt zugeführte (effektive) Spannung 141 Volt (100:√1⁄2) Gleichstromspannung und bei Drehstrom-Gleichstromumformern entsprechen 100 Volt Spannung zwischen zwei Schleifringen (Phasenstromspannung) 163 Volt (100:1⁄2√2⁄3) an den Bürsten.
Als „Gleichrichter‟ kann auch die Quecksilberdampflampe von Cooper Hewitt benutzt werden, die u. a. von der Firma Heräus in Hanau auf den Markt gebracht wird. Stellt man zwischen ungleichartigen Elektroden (z. B. zwischen Eisen und einer Dochtkohle) einen Wechselstromlichtbogen her,[91] so geht der Strom leichter in dem einen Sinne (vom Eisen zur Kohle) über als im anderen Sinne[75]. Bei der Quecksilberdampflampe sind die Elektroden Eisen und Quecksilber. In der Physikal.-Techn. Reichsanstalt wurden eingehende Versuche und zwar durchaus zufriedenstellende mit diesem Gleichrichter angestellt, die sich auf Einphasen- und Drehstrom bezogen[76]. Es ergab sich, daß der Spannungsverlust bei 3 Amp. 18 Volt und bei 10,5 Amp. 15 Volt betrug. Beträgt also die Netzspannung 150 Volt, so beträgt der Energieverlust bei 10,5 Amp. Stromstärke 10%. Ein Vorzug des Quecksilber-Gleichrichters besteht auch darin, daß er ohne Beaufsichtigung (während der Nacht) im Betrieb bleiben kann.
Die elektrolytischen Umformer, welche die Umwandlung von Wechselstrom in pulsierenden Gleichstrom bezwecken, beruhen auf folgendem Prinzip. Bildet man aus einer Aluminium- und einer Blei- (oder Platin-)elektrode und verdünnter Schwefelsäure (oder einer Lösung der Sulfate der Alkalien oder des Alauns) einen elektrolytischen Apparat, so fließt bei Verwendung von Gleichstrom, falls die Spannung einen gewissen Betrag nicht übersteigt, nur dann Strom durch die Zelle, wenn Aluminium die negative Elektrode ist (unipolare Elektrode). Man nimmt an, daß sich bei der umgekehrten Richtung das SO4 mit Aluminium zu einer sehr dünnen unlöslichen Schicht von basischem Aluminiumsulfat verbindet, das den elektrischen Strom nicht leitet[77]. Nachdem also eine geringe Elektrizitätsmenge[92] durch den Apparat geflossen ist, wird die Zelle zu einem Kondensator. Schaltet man eine hinreichend große Anzahl der Zellen hintereinander und verbindet die Endklemmen mit einem Wechselstromnetze, so wird von jeder Stromwelle die Hälfte unterdrückt und man erhält pulsierenden Gleichstrom[78].
Fig. 10.
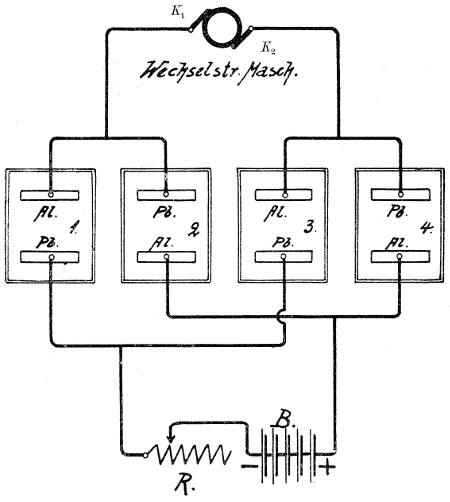
[93]
Sollen die beiden halben Wellen des Wechselstromes ausgenutzt werden, so wendet man die in Fig. 10 angegebene Schaltung an. Ist die Klemme K1 der Wechselstrommaschine die positive, so geht der Strom durch die Zelle 2, durch die zu ladende Batterie B, durch die Zelle 3 zur Maschine zurück; ist K2 positiv, so geht der Strom durch die Zellen 4 und 1. Für 110 Volt Wechselstrom genügen 4 Zellen.
Fig. 11.
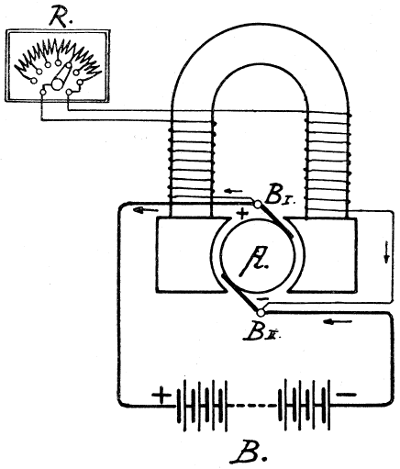
c) Laden mittels einer Gleichstrommaschine. Am besten eignet sich die Nebenschlußmaschine. Eine solche (mit 2 Polen) ist in Fig. 11[94] schematisch dargestellt. Der im Anker A erzeugte Strom teilt sich hinter der positiven Bürste; ein kleiner Teil (i) fließt durch die zahlreichen Windungen des linken Elektromagnetschenkels, durch den Regulierwiderstand R, die Windungen auf der rechten Seite und endlich durch die Bürste B2 zum Anker zurück. Der Hauptstrom J fließt durch die Akkumulatorenbatterie, deren positiver Pol mit der positiven Bürste verbunden sein muß.
Verringert man bei einer bestimmten Klemmenspannung den Widerstand in R (durch Drehen der Kurbel), so wächst i, der Erregerstrom, und es wird, falls die Feldmagnete nicht schon vorher gesättigt waren, das magnetische Feld verstärkt, so daß die elektromotorische Kraft der Maschine steigt. Umgekehrt kann man durch Vergrößerung von R die elektromotorische Kraft verringern. Da man mit Hilfe des Rheostates die Spannung regulieren kann, so nennt man ihn Regulator. Die Spannungsregulierung kann in ziemlich weiten Grenzen vorgenommen werden.
Wir wollen annehmen, daß die Tourenzahl der Maschine, wie es meistens zutrifft, nicht verändert werden kann. Man kann dann nur durch Verstärkung des Erregerstromes die Spannung steigern, natürlich nur so lange, bis die Elektromagnete gesättigt sind. Im allgemeinen wird nun die Maschine so gebaut, daß ihre Feldmagnete bei der normalen Spannung (z. B. 110 Volt) nahezu gesättigt sind. Soll eine Nebenschlußmaschine also zeitweise eine wesentlich höhere Spannung, als man sie gewöhnlich von ihr verlangt, liefern, so muß der Magnetismus der Feldmagnete bei der normalen Spannung noch ziemlich weit vom Maximum entfernt sein, d. h. das Material (das Eisen) wird nur zeitweise vollständig ausgenutzt, die Maschine ist also verhältnismäßig teuer.
Die Gründe, weshalb sich die Nebenschlußmaschine für die Ladung von Akkumulatoren besonders eignet, sind folgende. Da die Klemmenspannung eines Akkumulators[95] während der Ladung um 30-40% steigt[79], so muß, wenn man nicht durch einen Vorschaltwiderstand den Strom zuerst abschwächen will, die elektromotorische Kraft der Lademaschine allmählich erhöht werden, was, wie schon gezeigt, bei der Nebenschlußmaschine, ohne daß man die Tourenzahl ändert, leicht geschehen kann. Nehmen wir ferner an, daß die elektromotorische Kraft der Maschine aus irgend einem Grunde, etwa infolge Gleitens des Riemens, plötzlich so stark sinkt, daß sie kleiner wird als die Spannung der Batterie, die geladen wird; es schickt dann die Batterie Strom in die Maschine[80]. Man erkennt nun leicht, wenn man die Fig. 11 betrachtet, daß der durch die Elektromagnetwickelung fließende Akkumulatorenstrom dieselbe Richtung hat wie der von der Maschine selbst vor Eintritt der Störung in den Nebenschluß geschickte Strom. Die Feldmagnete ändern also ihre Polarität nicht, sie werden nicht umpolarisiert[81], und es behält daher auch die im Anker induzierte elektromotorische Kraft ihre Richtung bei; sie ist mithin stets der elektromotorischen Kraft der Batterie entgegengesetzt gerichtet. Hört die Störung auf, so wächst die induzierte elektromotorische Kraft, und die Maschine schickt wieder Strom in die Batterie.
Wie sich die Ladung gestaltet, hängt von verschiedenen Faktoren ab. Es soll nur ein bestimmter, in der Praxis häufig vorkommender Fall besprochen werden.[96] Es handle sich um eine Anlage mit 110 Volt; die Anzahl der Zellen sei 60, die Spannung der Nebenschlußmaschine möge bis zu 150 Volt erhöht werden können. Die Steigerung der Spannung um 40 Volt wird nun nicht allein durch Vergrößerung der Feldstärke des Magnetsystems, sondern auch durch Verringerung der Ankerrückwirkung bewirkt. Da aber die Ankerreaktion von der Ankerstromstärke abhängig ist, so ist man gegen Ende der Ladung, um die letzte Spannungserhöhung zu erzielen, gezwungen, den Strom zu verringern. — Bevor man die Dynamo auf die Batterie schaltet, mißt man die Klemmenspannung der Batterie, diese sei E. Dann erregt man die leer laufende Dynamo (mittels des Nebenschlußregulators) so, daß ihre Spannung um einige Volt höher ist als E und verbindet (durch Drehen des Schalters) die Dynamo mit der Batterie; unter Beobachtung des Ampermeters wird die elektromotorische Kraft der Maschine derartig reguliert, daß der gewünschte Ladestrom zustande kommt. Im Verlaufe der Ladung muß von Zeit zu Zeit eine Nachregulierung erfolgen.
Bei den angenommenen Verhältnissen kann die ganze Batterie so lange geladen werden, bis die Spannung pro Zelle 15060 = 2,5 Volt beträgt. Will man bis zu 2,7 Volt laden, so müssen einige Zellen abgeschaltet werden (s. Zellenschalter).
Wenn eine Dynamo vorhanden ist, die nur die für den normalen Betrieb nötige Spannung (z. B. 110 Volt) liefern kann, so wird in vielen Fällen eine Zusatzdynamo verwendet, die mit der Hauptmaschine in Reihe geschaltet wird und die fehlende Spannung liefert. Meistens wird die Zusatzdynamo durch einen Elektromotor angetrieben, dem Strom aus dem Netze zugeführt wird.
[97]
Wenn eine Zusatzmaschine nicht vorhanden ist und die Hauptmaschine nur die für die Speisung der Lampen und Motoren nötige Spannung liefert, so kann man die Batterie in zwei Hälften laden (s. S. 88). Hierbei muß eventuell ein Teil der Maschinenspannung in einem Vorschaltwiderstand getötet werden, dessen Größe man allmählich verringert. Sobald die Ladung der Batterie beendigt ist, werden die beiden Gruppen wieder hintereinander geschaltet.
Die Ladung in zwei Hälften ist mit größeren Energieverlusten verbunden. Besteht z. B. die Batterie bei 110 Volt Netzspannung aus 62 Zellen, und rechnen wir als mittlere Ladespannung 2,2 Volt, so müssen durchschnittlich (110 - 31 . 2,2) Volt = 41,8 Volt erdrosselt werden, so daß 38% der von der Dynamo abgegebenen Energie im Vorschaltwiderstand in Wärme umgesetzt werden. Die Ladung mit Zusatzmaschine wird daher vorgezogen.
Die Zusatzmaschine erhalte Strom von der Hauptmaschine. Rechnen wir den Wirkungsgrad des Antriebsmotors und den der Zusatzmaschine zu 85%, so ist der Wirkungsgrad des Aggregates gleich 0,85 . 0,85 = 0,7225. Der Energieverlust beträgt also bei unseren Annahmen 273⁄4% der dem Aggregate zugeführten Energie.
Eine Schaltung, die fast die ganze Netzspannung auszunutzen gestattet, hat Micka angegeben. Angenommen, es sollen bei 110 Volt Netzspannung 63 Zellen geladen werden. Aus diesen werden drei gleich große Gruppen gebildet, die wir mit I, II, III bezeichnen wollen. Die Zellen jeder Gruppe werden in Reihe und die beiden Gruppen II und III parallel geschaltet. Diese Doppelbatterie wird mit I in Serie geschaltet, so daß die für 42 Zellen erforderliche Spannung vorhanden sein muß. Gruppe I erhält also den vollen Ladestrom J, während II und ebenso III mit dem Strome J2 geladen werden. Mithin sind die Zellen der ersten[98] Gruppe früher geladen als die anderen. Nach Abschaltung von I werden II und III hintereinander geschaltet. Es ist auch hier die Vorschaltung eines Widerstandes nötig. Man kann auch in drei Zeitabschnitten laden, indem man z. B. zuerst unter Vorschaltung eines Widerstandes Gruppe I und II in Serie lädt, dann I und III und zuletzt II und III. (Siehe E. T. Z. 1908, S. 943).
d) Ladung mittels der Thermosäule. Die Verwendung der Thermosäule für die Ladung von Akkumulatoren ist besonders am Platze, wenn es sich um eine kleinere Anzahl von Zellen handelt. Das Verfahren ist höchst einfach, billig und mühelos: ein Vorschaltwiderstand ist überflüssig; die Einschaltung eines Ampermeters ist nicht erforderlich, einer Beaufsichtigung bedarf die Ladung nicht, man kann die Ladung auch während der Nacht fortsetzen; der Gasverbrauch beträgt pro Stunde 1⁄5 bis 1⁄6 Kubikmeter (für etwa 2 Pfg.); da endlich mit geringer Stromdichte geladen wird, so ist die chemische Umwandlung eine gründliche.
Die Gülchersche Thermosäule besteht aus 66 hintereinander geschalteten Elementen. Die elektromotorische Kraft ist am Abend etwas höher als am Tage, da die Gaswerke am Tage den Gasdruck auf einer etwas geringeren Höhe halten. Es ist jedoch nicht nötig, einen Gasdruckregulator, dessen Verwendung vielfach empfohlen wird, einzuschalten. Nach dem Anzünden der Gasflämmchen, das nicht sofort nach Öffnung des Gashahnes, sondern erst etwa 1⁄4 Minute später geschehen darf, steigt die elektromotorische Kraft zuerst schnell, dann langsam und erreicht in etwa 20 Minuten ihren Endwert von ca. 3,7 Volt (am Abend). Der innere Widerstand der Säule beträgt rund 0,7 Ohm. Man verbindet die Akkumulatoren erst einige Minuten nach dem Anzünden der Gasflammen mit den Polen der Thermosäule (+ mit +, - mit -), weil sonst der Akkumulator noch eine Zeitlang Strom abgibt. Wenn man sich vergewissern will, ob der Akkumulator auch wirklich Strom aufnimmt, so schaltet man ein Ampermeter[99] ein[82]. Bei Beginn der Ladung gibt die Thermosäule einen Strom von rund 2 Amper ab, später geht die Stromstärke etwas zurück.
Sind mehrere Zellen zu laden, so muß man diese parallel schalten, da die Spannung der Thermosäule schon für die Ladung von zwei in Reihe geschalteten Zellen zu klein ist. Es sei an dieser Stelle die Bemerkung eingeschoben, daß man bei der Parallelschaltung der Zellen keine Gewißheit hat, daß alle Zellen Strom aufnehmen[83]. Ist bei einer Zelle Sulfatierung erfolgt (s. S. 112), ihr Widerstand also sehr groß, oder ist ein Kontakt mangelhaft, oder ein Verbindungsdraht durchgebrochen o. dgl., so nimmt die Zelle keinen oder doch nur einen ganz schwachen Strom auf. Um sich zu vergewissern, ob in alle Elemente Strom fließt, verbinde man für einen Augenblick jede Zelle einzeln mit der Thermosäule (Einschaltung eines Ampermeters). Gegen Ende der Ladung sieht man zu, ob sich in jeder Zelle an beiden Elektroden Gase entwickeln.
Nach Beendigung der Ladung schaltet man zuerst den Akkumulator ab, dann bläst man die Gasflämmchen aus und dreht den Gashahn zu. Wenn man das Ausblasen unterläßt, erfolgt meistens eine Explosion, die der Thermosäule schaden kann.
Es schadet dem Akkumulator nicht, wenn man, bevor er gefüllt ist, die Ladung unterbricht, ihm Strom entnimmt und später die Ladung fortsetzt (s. jedoch Kap. 7). Auch darf man den Akkumulator aufladen, d. h. ihm Strom zuführen, ohne daß er vorher erschöpft war.
e) Wenn keine der vorher erwähnten Stromquellen für die Ladung der Akkumulatoren zur Verfügung steht, so muß man seine Zuflucht zu galvanischen Elementen nehmen.
Daniell-Elemente sind weniger geeignet, da ihre elektromotorische Kraft nur etwas mehr als 1 Volt (1,08) und ihr innerer Widerstand ziemlich groß ist. Man muß mindestens drei Elemente hintereinander[100] schalten. Gut brauchbar sind Bunsen-Elemente: Zink[84] in verdünnter Schwefelsäure (ca. 10%), Kohle in Salpetersäure. Das Element hat eine elektromotorische Kraft von etwa 1,8 Volt, der innere Widerstand beträgt bei den Elementen mittlerer Größe 0,1 bis 0,2 Ohm. Zwei Elemente genügen also für einen Akkumulator bezw. mehrere parallel geschaltete Zellen; die Stromstärke beträgt anfänglich 5-7 Amp. Da die Salpetersäure gesundheitsschädliche Dämpfe abgibt, so stellt man die Elemente unter den Gasabzug oder ventiliert den Raum gut, in dem die Ladung erfolgt.
Die Reichspostämter benutzen für die Ladung der Akkumulatoren vielfach Kupferelemente. Von einer Beschreibung dieses Elementes soll aber Abstand genommen werden.
Endlich sei noch erwähnt, daß manchmal die Ladung einer kleinen Batterie aus einer großen empfehlenswert ist. Wenn bei der großen Batterie Schaltzellen vorhanden sind, so entnimmt man den Strom den beiden letzten mit dem Zellenschalter verbundenen Elementen. Durch Einschaltung eines kleinen Widerstandes schwächt man den Strom ab.
3. Die Entladung. Schaltet man nach beendigter Ladung die Ladestromquelle ab, so beobachtet man an einem mit den Klemmen verbundenen Voltmeter, daß die elektromotorische Kraft des Akkumulators zuerst schnell und dann langsam zurückgeht. Erst nach Verlauf von 40-50 Minuten (wenn kein nennenswerter Strom entnommen wird) bleibt die Spannung konstant und hat dann den der Säuredichte entsprechenden Wert von 2-2,1 Volt (siehe S. 44). Für die Abnahme der Spannung lassen sich verschiedene Gründe angeben: (Verschwinden der Gaspolarisation?), Abnahme der hohen Säurekonzentration in den Poren, die zuerst schnell,[101] dann langsam erfolgt, Eindringen von Bleisulfat in den Elektrolyten, das eine Zunahme der Konzentration der Blei- und Bleisuperoxydionen zur Folge hat; ferner ist zu berücksichtigen, daß ein Teil der Ladespannung, wenn Gasentwicklung erfolgt, als Überspannung anzusehen ist, die, sobald man den Ladestrom abschaltet, wegfällt.
Fig. 12.
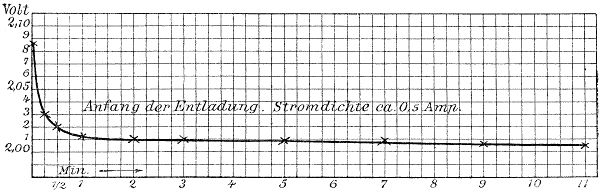
Manchmal beobachtet man, daß nach Abschaltung der Ladestromquelle noch eine ziemlich starke, kurze Zeit dauernde Gasentwicklung erfolgt. Dolezalek erklärt diese Erscheinung folgendermaßen[85]: „Hat man durch lange Überladung alles auf der Elektrode befindliche Sulfat zersetzt, so bildet sich das Sulfat durch freiwillige Entladung (s. S. 106) zurück, was sich durch eine starke, kurz dauernde Wasserstoffentwicklung bei Öffnung des Ladestromes zu erkennen gibt‟. Es ist aber auch möglich, daß das sogen. Nachkochen durch metallische Verunreinigungen hervorgerufen wird (s. Selbstentladung).
Wird der Akkumulator entladen, so sinkt die [102]Klemmenspannung zunächst sofort um den Betrag i · wi[86], hierzu kommt in den ersten Minuten ein ziemlich starker Spannungsabfall, der durch den Schwefelsäureverbrauch in den Poren der aktiven Masse und in unmittelbarster Nähe der Elektrodenoberfläche zu erklären ist (s. S. 48). Wie man ferner aus der Entladekurve, von der ein Teil in Fig. 12 abgebildet ist, ersehen kann, bleibt die Spannung nach dem ersten Abfall längere Zeit nahezu konstant: das Hineindiffundieren der Säure in die Poren hält gleichen Schritt mit dem Säureverbrauch für die Sulfatbildung. Den betreffenden Unterschied der Konzentration der äußeren (Ca) und der inneren Säure (Ci) wollen wir δ nennen. Nun nimmt im Laufe der Entladung Ca ab; soll also δ konstant bleiben, so muß auch Ci abnehmen. Die Spannung muß demnach, der Abnahme der Konzentration der äußeren Säure (wie sie mittels eines eingetauchten Aräometers gemessen wird) entsprechend, langsam sinken. Je mehr Elektrizität man dem Akkumulator entnimmt, um so mehr wird, wie schon gezeigt wurde, der Säure das Eindringen in die aktive Masse erschwert. Daher ist gegen Ende der Entladung ein schnellerer Spannungsabfall zu erwarten (s. Fig. 13).
Man hört mit der Entladung auf, wenn die Klemmenspannung bei Stromentnahme 1,83 bis 1,8 Volt beträgt, weil eine zu weit getriebene Entladung dem Akkumulator schädlich ist und durch sie die folgende Ladung erschwert wird; auch gibt ein Akkumulator, wenn er bis zu dem angegebenen Punkte entladen ist, keine beachtenswerte Elektrizitätsmenge mehr ab. (S. auch „Erholung‟ S. 105 und „Behandlung‟ Kap. 7.)
Bei Zentralen kommt noch hinzu, daß, wenn man mit der Entladespannung noch unter 1,8 Volt heruntergehen wollte, das Konstanthalten der Spannung in der Zentrale umständlich wäre und die Zahl der Zellen vergrößert werden müßte. Diese nämlich ist abhängig[103] von der Netzspannung und der Endspannung der Zellen. Bei 110 Volt Netzspannung sind 1101,8 Zellen erforderlich.
Fig. 13[87].
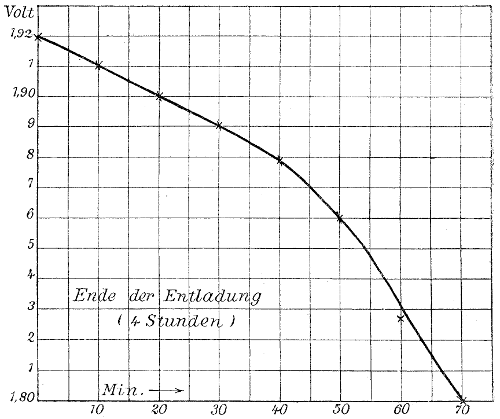
Wie bei der Ladung, so darf auch bei der Entladung eine gewisse Stromdichte nicht überschritten werden — wenigstens für längere Zeit nicht, weil sich die Platten bei zu starker Stromentnahme (infolge der plötzlichen und starken Volumänderungen) krümmen („werfen‟) und die aktive Masse abbröckeln kann. Durch eine stärkere Krümmung der Platten kann ein innerer Kurzschluß herbeigeführt werden, der, falls er nicht bald beseitigt wird, zu einem vollständigen Ruine des Akkumulators führt. Die maximale Stromstärke wird von den Fabriken[104] für die einzelnen Typen angegeben und ist meistens gleich der maximalen Ladestromstärke (s. auch Kap. 7).
Nur dann, wenn man mit sehr geringer Stromdichte entlädt, wird fast alles Bleisuperoxyd in Bleisulfat umgewandelt. Wie durch Ayrton, Lamb und Smith nachgewiesen wurde, bleiben selbst bei 15stündiger Entladung noch 40% des bei Beginn der Entladung vorrätigen Bleisuperoxydes zurück. Entsprechendes wird für den Bleischwamm gelten (s. Kapazität). Es erklärt sich so die Tatsache, daß positive „entladene‟ Platten noch eine braunrote Farbe haben.
[67] Die Spannung in den verschiedenen Stadien der Ladung ist von der Säuredichte, der Plattenkonstruktion usw., vor allem aber von der Stromdichte abhängig.
[68] Die Akkumulatoren für stationäre elektrische Anlagen. 4. Aufl. 1906.
[69] In der Formel für die elektromotorische Kraft des Akkumulators kommt das Produkt dieser beiden Konzentrationen im Nenner vor.
[70] E. T. Z. 1900 Nr. 14 ff.
[71] Der einstündigen Entladung entsprechend.
[72] Über die Anfertigung von Polreagenzpapier siehe Lüpke-Bose, Grundzüge der Elektrochemie, 5. Aufl. S. 22.
[73] Schaltungsschema siehe Figur 2 a. S. 26.
[74] Man muß also, wenn man die Gleichstromspannung variieren will, die Spannung des Wechselstromes ändern; es kann dies durch Einschaltung von Drosselspulen oder mittels Transformatoren mit abschaltbaren Spulen geschehen.
[75] Siehe E. T. Z. 1900 S. 336 u. 403, 1903 S. 187 u. 395.
[76] E. T. Z. 1909 S. 297. Siehe auch Handbuch der Elektrotechnik I, 2 S. 362.
[77] Nach einer anderen Erklärung bildet sich, wenn das Aluminium Anode ist, Al2O3.
[78] Näheres siehe E. T. Z. 1903, S. 432 und 527.
[79] Von rund 2 Volt bis zu etwa 2,7 Volt.
[80] Man kann durch Einschaltung eines Schwachstromautomats (Minimalausschalters) in die Ladeleitung verhindern, daß die Batterie Strom in die Dynamo schickt; jedoch kann es vorkommen, daß der Automat nicht funktioniert.
[81] Bei der Hauptstrommaschine würden die Feldmagnete umpolarisiert werden.
[82] Wenn der Akkumulator keinen Strom aufnimmt, so zeigt ein mit seinen Klemmen verbundenes Voltmeter die Spannung der Thermosäule an.
[83] Wenn ein Aräometer nicht benutzt wird. Gegen Ende der Ladung ist das Ausbleiben der Gasentwicklung ein Zeichen.
[84] Das Zink muß amalgamiert werden, weil sonst der Zinkverbrauch zu groß ist. Der theoretische Zinkverbrauch beträgt pro Amperstunde nur 1,2 Gramm. Je mehr Wasserstoff sich an der Zinkelektrode entwickelt, um so mehr wird die theoretische Zinkmenge überschritten.
[85] l. c. S. 63.
[86] Dieser ist, wenn nur ein Voltmeter von größerem Widerstand mit den Klemmen verbunden ist, verschwindend klein; bei dem der dreistündigen Entladung entsprechenden Strome beträgt wi · i einige Hundertstel Volt.
[87] Der Akkumulator wurde mit einer Stromdichte von etwa 0,6 Amp. (bezogen auf die Positiven) entladen. — Die Gestalt der Entladungskurve hängt von der Stromstärke ab. Je größer die Stromdichte ist, um so stärker ist der Spannungssturz in den ersten Minuten und gegen Ende der Ladung.
[105]
1. Erholung. Wir haben gesehen, daß die Klemmenspannung eines Akkumulators bei der Entladung sinkt, weil der Elektrolyt im Innern der Platten und dicht an der Oberfläche an Säure verarmt. Für die Richtigkeit dieser Erklärung spricht auch diejenige Erscheinung, die man als Erholung bezeichnet. Sie besteht darin, daß nach Verringerung der Belastung, besonders nach Öffnung des Stromkreises, infolge des Ausgleiches der Konzentrationsunterschiede die Spannung zuerst schnell, dann langsam bis zu dem der augenblicklichen Dichte der ganzen Säure entsprechenden Werte steigt. Wenn man die Erscheinung der Erholung nicht kennt oder nicht beachtet, so kann man sich leicht über den Zustand des Akkumulators täuschen. Aus dem Umstande, daß die elektromotorische Kraft rund 2 Volt beträgt, darf man nicht schließen, daß noch eine große Elektrizitätsmenge aufgespeichert sei. Dies geht aus den folgenden Messungen hervor.
Eine Zelle, die bei vierstündiger Entladung eine Kapazität von etwa 16 Amperstunden hat, wurde mit 4 Amp. entladen; die anfängliche elektromotorische Kraft betrug 2,08 Volt. Nach 1 Stunde zeigte das Voltmeter eine Klemmenspannung von 1,95 Volt an; die Entladung[106] wurde unterbrochen. Als sie nach 15stündiger Ruhe fortgesetzt wurde, ergab sich eine elektromotorische Kraft von 2,03 Volt; 31⁄6 Stunden später belief sich die Klemmenspannung auf 1,8 Volt. Nach 5stündiger Pause zeigte das Voltmeter 2,02 Volt an; bei Entnahme von 4 Amp. fiel die Spannung in 5 Minuten auf 1,83 Volt. Aus diesen Beobachtungen ergibt sich wohl von selbst, was man zu tun hat, wenn man sich ein Urteil über die Frage bilden will, wann man mit der Stromentnahme aufhören muß.
2. Selbstentladung. Läßt man einen geladenen Akkumulator unbenutzt stehen, so nimmt seine Kapazität von Tag zu Tag ab, und die Säuredichte sinkt allmählich. Die langsam infolge chemischer Prozesse, die sich in der offenen Zelle abspielen, erfolgende Abnahme der Nutzkapazität bezeichnet man als Selbstentladung.
Hierzu gehört also nicht die durch mangelhafte Isolation verursachte Entladung, die besonders bei Batterien für hohe Spannungen eine Rolle spielt. Der Vorgang ist folgender: Von der positiven Klemme der Batterie fließt ein schwacher Strom durch die Säure über die feuchte Wand der Zelle usw. zum negativen Pole der Batterie. Außerdem können Ströme von dem positiven Pole einer Zelle über die Glaswand nach dem negativen Pole derselben Zelle übergehen.
Die Umwandlung von Blei und Bleisuperoxyd in Bleisulfat, die erfolgt, ohne daß der Akkumulator Strom abgibt, kann durch verschiedene Erscheinungen verursacht werden.
a) Die Säure absorbiert Sauerstoff der Luft; gelangt dieser an die Bleischwammelektrode, so wird Blei oxydiert. Da die Absorption und Diffusion[88] des Sauerstoffs nur sehr langsam erfolgen, so ist die betreffende Kapazitätsabnahme nur gering.
[107]
b) Bei der Ladung sättigt sich die Säure in der Nähe der Elektroden und in den Poren der aktiven Masse mit Sauerstoff bezw. mit Wasserstoff, auch werden von den Elektroden selbst geringe Mengen dieser Gase aufgenommen (Okklusion). Nach beendigter Ladung diffundiert der Wasserstoff langsam in die Säure hinein und gelangt nach der positiven Elektrode, wo er reduzierend wirkt; der Sauerstoff wandert langsam nach der Bleiplatte, wo er Oxydation hervorruft. Auch die diesen Vorgängen entsprechenden Verluste spielen keine große Rolle.
c) Größere Elektrizitätsverluste können durch die Anwesenheit von fremden Metallen in der Schwefelsäure verursacht werden. Jedoch sind keineswegs alle Metalle zu den schädlichen zu rechnen, sondern nur diejenigen, die mit Blei in verdünnter Schwefelsäure ein galvanisches Element bilden, bei dem Blei der negative Pol ist. Wir werden hierauf unten noch näher eingehen. Einstweilen nehmen wir an, daß ein schädliches Metall, etwa Platin, in der Akkumulatorsäure enthalten sei. Durch Blei wird das Platin ausgefällt, es schlägt sich also Platin auf der Bleischwammelektrode nieder (wie sich Kupfer auf einem Zinkstabe niederschlägt, den man in die Lösung eines Kupfersalzes eintaucht). Es sei jetzt an folgenden Versuch erinnert: Befinden sich ein Zinkstab und eine Kupferplatte in verdünnter Schwefelsäure, und neigt man die Metalle so, daß sie sich innerhalb der Säure berühren, so beobachtet man an der Berührungsstelle lebhafte Gasentwickelung (Wasserstoff). Die Anordnung bildet ein innerhalb der Säure kurz geschlossenes Voltasches Element; der Strom geht vom Kupfer durch die Berührungsstelle zum Zink, durch die Säure zum Kupfer zurück. In unserem Akkumulator befinden sich nun außerordentlich viele,[108] sehr kleine kurzgeschlossene Elemente, jedes Platinteilchen bildet mit seiner Unterlage ein solches. Die Vorgänge sind ähnliche wie diejenigen, die sich in dem Voltaschen Elemente abspielen (s. S. 22) und können durch die Gleichung dargestellt werden
Pb + H2SO4 = PbSO4 + H2.
Dieses gilt auch, wenn sich ein anderes schädliches Metall in dem Elektrolyten befindet.
Die eben erwähnten sehr kleinen Elemente nennt man Lokalelemente und die entsprechenden chemischen Vorgänge Lokalaktion. Da infolge der Lokalaktion Blei in Bleisulfat umgewandelt wird, so muß die Kapazität der negativen Platte abnehmen.
Je leichter die Wasserstoffentwicklung an einem der schädlichen Metalle erfolgt, um so stärker werden die Lokalströme, um so schneller erfolgt die Selbstentladung. Wenn man daher die Metalle nach dem Grade ihrer Schädlichkeit in eine Reihe ordnen will, so muß man die „Überspannung‟ mit berücksichtigen (s. S. 13). Beträgt diese bei einem Metalle mehr als die elektromotorische Kraft der Kombination Blei | verdünnte Schwefelsäure | Wasserstoffelektrode, so kann eine Wasserstoffentwickelung, falls sich das betreffende Metall in der Säure bezw. auf der Bleischwammelektrode befindet, nicht erfolgen und demnach auch keine Umwandlung von Blei in Bleisulfat. Nach Dolezalek[89] sind folgende Metalle dem Akkumulator gefährlich: Platin, Gold, Eisen, Silber, Nickel, Kupfer, und zwar Platin am meisten, Kupfer am wenigsten[90].
[109]
Daß Platin dem Akkumulator schädlich ist, zeigt ein einfacher Versuch: Berührt man mit einem Platindrahte oder mit einem Platinblech innerhalb der Säure eine negative Platte, so beobachtet man lebhafte Gasentwickelung. — Spuren von Platin können in die Schwefelsäure gelangen, wenn dieselbe in einem Platinkessel eingedampft wird. Es genügen ganz minimale Mengen von Platin, den Akkumulator unbrauchbar zu machen; die anderen Metalle sollen, wenn sie nur in sehr geringer Menge zugegen sind, im Laufe der Zeit am Schädlichkeit abnehmen, wahrscheinlich, weil sie sich mit dem Blei langsam legieren.
Kupfer kann besonders bei offenen Zellen, die im Laboratorium benutzt werden, in die Säure gelangen, wenn Messingklemmschrauben oder Kupferdrähte an die Pole befestigt werden. Durch Säuredämpfe oder durch Säurepartikeln, die bei der Ladung von den entweichenden Gasblasen mitgerissen werden, vielleicht auch durch „kriechende‟ Säure, wird das Kupfer angegriffen, es bildet sich ein Kupfersalz, von dem sich Teilchen loslösen usw. — Stehen Akkumulatoren in der Nähe einer Dynamomaschine, bei der Kupferbürsten benutzt werden, so können kleine Kupferpartikelchen in die Säure fliegen.
Eine bis jetzt noch nicht aufgeklärte Beobachtung hat Kugel[91] gemacht. Er fand, daß, wenn mehrere Metalle, die für sich allein nur in geringem Grade schädlich sind, gleichzeitig in der Säure zugegen sind, eine stärkere Selbstentladung erfolgt.
Durch Untersuchungen von Kayser und Ost soll nachgewiesen sein, daß Kupfer, wenn es allein in der Säure vorkommt, eine Entladung nicht hervorruft; jedoch fand auch dann Selbstentladung statt, sobald ein zweites geeignetes Metall in der Säure war (s. Hoppe, Die Akkumulatoren für Elektrizität). — Verfasser weiß aus Erfahrung, daß Zellen, in die Kupferstaub geraten war, vollständig verdorben wurden.
[110]
Wenn durch metallische Verunreinigungen eine Selbstentladung verursacht wird, so gasen die Negativen nach Unterbrechung des Ladestromes noch längere Zeit nach und die Dichtigkeit der Akkumulatorsäure nimmt ab, dementsprechend sinkt die elektromotorische Kraft langsam.
d) Ferner ist die Anwesenheit schädlicher Metalle in den Platten selbst zu erwähnen. Hier gelten dieselben Betrachtungen wie eben. Natürlich kann eine metallische Verunreinigung nur dann Selbstentladung verursachen, wenn das betreffende Metall mit der Säure in Berührung kommt.
e) Lokalaktion an der positiven Platte. Dort findet eine Berührung zwischen Blei- und Bleisuperoxydteilchen statt, die mit hinzutretender Schwefelsäure Lokalelemente bilden. Die Lokalaktion besteht in der Umwandlung von Bleisuperoxyd der aktiven Masse und Blei des Trägers in Bleisulfat, bewirkt also eine Abnahme der augenblicklichen Kapazität der positiven Platten (und eine Zunahme der späteren, s. Formation).
Auch an der negativen Elektrode sollen nach Darrieus Lokalaktionen stattfinden (?), da Hartblei (s. S. 118) und Bleischwamm in verdünnter Schwefelsäure ein galvanisches Element von 0,520 Volt (nach Sieg von 0,225 Volt) bilden.
f) Endlich kann eine ganz schwache Selbstentladung durch Verunreinigungen der Säure herbeigeführt werden, die leicht oxydierbar sind und in zwei verschiedenen Oxydationsstufen vorkommen, z. B. Eisen, das Ferro- und Ferrisalze bildet. Sie nehmen an der positiven Elektrode Sauerstoff auf, diffundieren als sauerstoffreiche Verbindungen nach der negativen Elektrode hin, geben dort Sauerstoff ab, gelangen durch Diffusion wieder nach der positiven Platte usw.
[111]
Die Geschwindigkeit, mit der die Selbstentladung erfolgt, wächst mit der Konzentration der Säure, weil die elektromotorischen Kräfte der verschiedenen in Betracht kommenden Elemente mit der Säuredichte ansteigen. Dies gilt besonders von der Kombination Blei | verdünnte Schwefelsäure | Wasserstoff. Je größer die elektromotorische Kraft dieser Kette ist, je mehr sie also die „Überspannung‟ übertrifft, um so leichter erfolgt Wasserstoffentwicklung. Ist die Säure stark konzentriert, so kann sich auch chemisch reines Blei unter lebhafter Wasserstoffentwicklung auflösen (es gehen Bleiionen in die Lösung und Wasserstoffionen aus der Lösung auf das Blei, wo sie ihre Ladung abgeben und als Blasen entweichen[92]).
Über die Größe der Stromverluste infolge der Selbstentladung[93] können genaue Angaben nicht gemacht werden; sie hängt eben von Zufälligkeiten ab, vor allem von der Reinheit der Materialien und von der Konstruktion der Platten. Für positive Platten wird sie im allgemeinen eine andere sein als für negative. Ferner dürfte die Selbstentladung um so größer sein, je weiter die sogen. Oberflächenentwicklung getrieben ist, lehrt doch die Erfahrung, daß für Großoberflächenplatten der Verlust durch freiwillige Entladung in einer bestimmten Zeit bedeutend größer ist als für sogen. Masseplatten[94].[112] In den ersten Tagen nach der Ladung ist der prozentuale Verlust größer als später.
Da die Selbstentladung mit einem Verbrauch von Schwefelsäure Verbunden ist, so kann man sich mit Hilfe des Aräometers ein angenähertes Bild von dem Zustande der Zelle verschaffen.
Auf die Schlüsse, die sich aus der Selbstentladung für die Praxis ergeben, wird später näher eingegangen (s. Kap. 7). Hier sei nur darauf aufmerksam gemacht, daß man bei der Wahl des Systems in manchen Fällen auf die Selbstentladung Rücksicht nehmen muß. Je größer die Selbstentladung ist, um so größer ist die Gefahr, daß der Akkumulator Schaden leidet, wie sich aus dem folgenden Abschnitte ergibt.
Sulfatierung. Läßt man einen Akkumulator in entladenem Zustande längere Zeit stehen, so beobachtet man, daß sich auf der Oberfläche der Platten weiße Flecke bilden, die im Laufe der Zeit an Größe zunehmen; schließlich (nach mehreren Wochen) ist die ganze Oberfläche mit einer weißen Schicht bedeckt. Wie die chemische Analyse zeigt, besteht die Masse, die sich auf den Platten ansetzt, aus reinem Bleisulfat (daher der Name Sulfatierung oder Sulfatisierung). Diese Sulfatschicht unterscheidet sich von dem bei jeder Entladung entstehenden Bleisulfat dadurch, daß sie aus größeren Krystallen besteht, während letzteres einen mit Schwefelsäure überall durchtränkten Überzug bildet. Wir müssen also schließen, daß die Sulfatierung auf eine physikalische Veränderung des schwefelsauren Bleies zurückzuführen ist. Elbs[95] gibt folgende Erklärung: Die Löslichkeit des Bleisulfates in verdünnter Schwefelsäure nimmt mit der Temperatur schnell zu. Nun unterliegt die Temperatur des Raumes, in dem sich[113] der Akkumulator befindet und daher auch die Temperatur der Säure forwährenden Schwankungen. Steigt die Temperatur (am Tage), so geht neues, an den Elektroden vorrätiges Bleisulfat in Lösung, sinkt die Temperatur (abends, in der Nacht), so scheidet sich ein Teil des gelösten Sulfates in kristallinischem Zustande ab. Bei dem folgenden Temperaturanstieg geht wieder Sulfat in Lösung. Da sich aber das strukturlose, bei der vorhergegangenen Entladung entstandene Salz leichter löst, so nehmen die schon vorhandenen Kristallnadeln nur wenig an Größe ab. Bei der nächsten Abkühlung geht wieder Bleisulfat aus der Lösung heraus und setzt sich an die vorhandenen Kristallnadeln an. So wachsen also die Kristalle im Laufe der Zeit auf Kosten des bei der Entladung entstandenen Sulfates, bis schließlich die ganze Oberfläche mit einer zusammenhängenden, für Flüssigkeiten fast undurchdringlichen Kruste von kristallinischem Bleisulfat bedeckt ist.
Für die Richtigkeit dieser Erklärung dürfte der folgende vom Verfasser angestellte Versuch sprechen: In verdünnte Schwefelsäure, in der sich fein verteiltes Bleisulfat befand, wurde eine Bleiplatte eingetaucht. Nach Verlauf von mehreren Wochen war die Bleiplatte zum Teil mit einer ziemlich dicken, weißen Kruste bedeckt. Besonders stark hatte sich das Bleisulfat an den Teilen der Platte angesetzt, die sich in der Nähe der Oberfläche der Säure befanden. Dort nimmt die Säure am leichtesten die Temperatur der Umgebung an (das Glasgefäß war luftdicht abgeschlossen).
Schließt man eine Zelle, in der stärkere Sulfatierung erfolgt ist, an ein Voltmeter an, so findet man, daß ihre elektromotorische Kraft nahezu Null ist. Die folgende Ladung ist mit erheblichen Schwierigkeiten verbunden, weil der innere Widerstand der Zelle ein ungewöhnlich großer ist. Die starke Zunahme des inneren Widerstandes ist darauf zurückzuführen, daß die Sulfatschichten dem Strome das Eindringen in den Elektrolyten[114] erschweren[96]. Nimmt die Zelle Strom auf, so sinkt der innere Widerstand einige Zeit nach Beginn der Ladung langsam.
Die Erfahrung lehrt, daß bei einem Akkumulator mit sulfatierten Platten die Ladung mit Ruhepausen von Vorteil ist; man lädt also kurze Zeit, schaltet die Stromquelle ab, setzt nach einiger Zeit die Ladung fort usw. Ferner soll sich die schädliche Sulfatschicht auf den Positiven leichter entfernen lassen als auf den Negativen.
Meines Erachtens ist die Erklärung für diese Erfahrungstatsachen folgende: 1. Das kristallinische Bleisulfat löst sich nur sehr langsam in der Säure; daher wird, auch wenn mit kleiner Stromdichte geladen wird, bei Stromzufuhr mehr Bleisulfat herauselektrolysiert als sich löst, so daß die Säure bald an Bleisulfat verarmt. Während der Ruhepause sättigt sich die Säure mit Bleisulfat usw. 2. Die Dichte der Säure unmittelbar an der Oberfläche der positiven Elektrode nimmt bei der Ladung stärker zu als an der negativen Platte, da an ersterer nach der Sulfattheorie Wasser verbraucht und Schwefelsäure gebildet wird. Die Löslichkeit des Bleisulfates wächst mit der Säuredichte schnell[97]. Man darf daher wohl den Schluß ziehen, daß das kristallinische Bleisulfat der positiven Platten leichter und schneller in Lösung geht, als dasjenige an der negativen Elektrode.
Die Neigung zur Sulfatierung wächst mit der Säuredichte, weil die Löslichkeit des Bleisulfates — für das hier in Betracht kommende Intervall — mit dem Schwefelsäuregehalt steigt (s. Fußnote) und damit die Geschwindigkeit einer Umkristallisierung.
Auf den ersten Blick hat es den Anschein, als ob bei einer Zelle, die ein Glied einer Akkumulatorenbatterie ist, Sulfatisierung ausgeschlossen sei, wenn die[115] Batterie nach Vorschrift geladen und entladen wird. Dies ist aber keineswegs der Fall. Nehmen wir nämlich an, daß bei einer Zelle, die wir mit Z bezeichnen wollen, eine leitende Verbindung zwischen einer positiven und einer negativen Platte entstanden sei, etwa durch herabgefallene aktive Masse. Es fließt dann fortwährend Strom von der positiven Elektrode durch den Kurzschluß nach der negativen Platte, so daß die Zelle viel früher entladen ist als die anderen Elemente. Erfolgt die nächste Ladung, so fließt der Ladestrom in Z zum Teil durch die Säure, zum größten Teil durch den metallischen Leiter in der Zelle, und dieser letztere Teil kommt für die Elektrolyse nicht in Betracht. Sind also die übrigen Zellen vollgeladen, so ist Z noch weit zurück. Nach der Ladung entlädt sich die betreffende Zelle ziemlich schnell. Sie befindet sich also fast immer im entladenen Zustande, wodurch die Sulfatierung begünstigt wird. Denn je mehr fein verteiltes Sulfat vorhanden ist, um so leichter kann sich kristallisiertes Sulfat bilden.
Ferner kann Sulfatierung erfolgen, wenn die Kapazität eines Elementes aus irgend einem Grunde kleiner ist als diejenige anderer, mit denen es in Serie geschaltet ist, wenn z. B. ein altes Element mit einem neuen zusammenarbeitet. Die betreffende Zelle wird dann bei jeder Entladung der Batterie zu stark beansprucht; die Ladung wird erschwert, die zwischen Ladung und Entladung liegende Zeit ist bei ihr größer als bei den übrigen Zellen.
Die Erfahrung lehrt, daß die Sulfatierung schneller erfolgt, wenn die Entladung zu weit getrieben wird. Sie ist oft mit einer Krümmung der Platten verbunden, durch die ein innerer Kurzschluß herbeigeführt werden kann.
[88] Die Absorption erfolgt an der Oberfläche der Säure, durch Diffusion gelangt der absorbierte Sauerstoff in das Innere.
[89] Dolezalek l. c. S. 75.
[90] Verbindet man eine frisch geladene Bleischwammelektrode und ein Kupferblech (beide in verdünnter Schwefelsäure) mit einem empfindlichen Voltmeter, so findet man, daß die Spannung schnell auf einige Millivolt fällt.
[91] Elektrot. Ztschr. 1892 S. 12.
[92] Die Säure muß, wenn dieses geschehen soll, eine so große Dichte haben, daß die elektromotorische Kraft der vorhin erwähnten Kette gleich der Überspannung für Blei ist, nämlich 0,64 Volt.
[93] Nach Bein (Elemente und Akkumulatoren, Leipzig 1908, S. 184) soll die Selbstentladung in Schwefelsäure von 1,8 Dichte nach 2 Tagen bis zu 14% betragen. Unter normalen Verhältnissen dürfte jedoch der Verlust durch Selbstentladung viel geringer sein. Auch Dolezalek gibt kleinere Zahlen an.
[94] Man vergl. die Untersuchungen von Albrecht, E. T. Z. 1907, Seite 539.
[95] Elbs, Die Akkumulatoren, 4. Aufl., S. 46.
[96] Daß der Elektrolyt, wie vielfach behauptet wird, stark an Säure verarmt, konnte der Verfasser nicht finden.
[97] Aus dem vorhandenen Beobachtungsmaterial muß man schließen, daß die Löslichkeit des Bleisulfates mit der Säuredichte zuerst abnimmt, bei etwa 1,22 ein Minimum hat und dann stark steigt.
[116]
I. Plattenkonstruktionen. Planté, den wir bereits als den Erfinder des Bleiakkumulators kennen lernten (s. S. 34), benutzte für seine Untersuchungen glatte Bleiplatten; von diesen wurden zwei aufeinandergelegt und durch Kautschukbänder voneinander getrennt; das Ganze wurde zu einer Spirale aufgewickelt. Bei solchen glatten Platten eine auch nur einigermaßen befriedigende Kapazität zu erhalten, war sehr umständlich (s. Formation).
Um die Kapazität zu erhöhen und die Formationszeit zu verringern, trug Faure[98], dessen Deutsches Patent vom 8. Februar 1881 datiert ist, auf glatte Bleiplatten einen aus Bleioxyden (Bleiglätte, Mennige) und verdünnter Schwefelsäure hergestellten dicken Brei auf. Die Schicht wurde durch einen Überzug aus poröser Masse (Filz oder dergl.) festgehalten.
Eine bedeutende Vereinfachung und Verbesserung des Faureschen Verfahrens erzielte Volckmar — Patent vom 9. Dez. 1881 — dadurch, daß er als Träger der aktiven Masse Bleiplatten benutzte, in denen sich[117] zahlreiche rechteckige oder sonstwie geformte Löcher befanden. Die Rippen verjüngten sich nach außen. Die Füllmasse, die sogenannte Paste, wurde als Brei in die Löcher eingetragen; sie bestand aus Bleipulver oder Bleimehl, das mit verdünnter Schwefelsäure angerührt wurde. Volckmar ist also der Erfinder der sogenannten Gitterplatten, die man auch wohl gepastete oder pastierte Platten oder Masseplatten nennt.
De Kabath suchte bei möglichst kleinem Gewichte der Platten, ohne Bleisalze zu verwenden, eine möglichst große Oberfläche zu erzielen. Er stellte wellenförmige Bleistreifen von 1 cm Breite her, die in Bleischeiden geschoben wurden.
Fig. 14.
In der Folgezeit wurden zahlreiche Gitterkonstruktionen erfunden; nomen eorum est legio. Die meisten waren aber Eintagsfliegen, sie konnten sich im Betriebe nicht bewähren, vor allem weil dem Umstande nicht genügend Rechnung getragen war, daß die kleinen Kuchen oder Pastillen beim Laden und Entladen ihr Volumen ändern, so daß der Zusammenhang zwischen der aktiven Masse und den Gitterstäben mangelhaft wurde oder die Pastillen rissen und herausfielen. Um diese Übelstände zu beseitigen, konstruierte Correns (1888) eine Platte, die man als Doppelgitter bezeichnen kann. Wie man sieht, haben die Stege a b dreieckigen Querschnitt, und es liegen je zwei, etwas gegeneinander versetzt, übereinander (siehe Fig. 14). Die Pastillen sind in der Mitte infolgedessen etwas eingeschnürt. Die zwischen je zwei Querbalken c d liegenden Felder stehen im Zusammenhang. Das Corrensgitter wird von den Akkumulatoren- und Elektrizitätswerken vorm. W. A.[118] Boese in Berlin hergestellt. Auf die Entwicklung der Großoberflächenplatten werden wir noch zurückkommen. Wir wenden uns jetzt zu den neueren Konstruktionen; es sollen aber nur die bekanntesten deutschen Fabrikate berücksichtigt werden. Man kann die Akkumulatorenplatten nach verschiedenen Gesichtspunkten einteilen. 1. Mit Rücksicht auf die Verwendung, die der Akkumulator finden soll, kann man unterscheiden zwischen Platten für stationäre und transportable Elemente. Bei ersteren kommt es auf das Gewicht weniger an, verlangt wird eine große Lebensdauer. Diese ist, wie wir noch sehen werden, bei dicken Platten größer als bei dünnen. Auch die Beanspruchung im Betriebe wird bei der Konstruktion bezw. bei der Wahl der Platten eine Rolle spielen; für Pufferbetrieb wird man eine andere Platte wählen als für Telephonbetrieb.
2. Man kann ferner inbezug auf das Material unterscheiden zwischen Platten aus reinem Blei oder einer Legierung von Blei und Antimon, die man Hartblei nennt, und Platten aus Blei und Bleisalzen (Paste): zwischen Großoberflächen- oder Planté-Platten und Masse- oder Faure-Platten. Mit Rücksicht auf den Träger der wirksamen Masse[99] kann man einteilen in Kernplatten, d. h. Platten, die in der Mittelebene einen zusammenhängenden Kern haben, auf dem sich die Rippen oder dergl. erheben, in Einfachgitterplatten und Doppelgitter.
Großoberflächenplatten. Die große Oberfläche erzielt man dadurch, daß man die Platte mit[119] zahlreichen Rippen, Zähnen, Leisten u. dergl. versieht. Die von der Säure benetzte, daher der Stromwirkung zugängliche Oberfläche nennt man die abgewickelte Oberfläche.
Hat eine Platte von 1 dm Länge und 1 dm Breite, deren projizierte Oberfläche also 1 dm2 beträgt, eine abgewickelte Oberfläche von 4 dm2, so sagt man, daß die Oberflächenentwickelung eine vierfache sei. Die Großoberflächenplatte wurde besonders von den Gebrüdern Tudor (Akkumulatorenfabrik Aktien-Gesellschaft, Hagen i. W.) ausgebildet.
Anfänglich wurden die Platten (positive), die auf beiden Seiten mit relativ hohen, dünnen Rippen versehen waren, bis sie die volle Kapazität erreicht hatten, nach Planté formiert (s. S. 127). Dieses Verfahren war langwierig und sehr kostspielig. Daher wurden die Platten später zuerst eine Zeitlang nach Planté formiert; dann wurden die Zwischenräume zwischen den Rippen mit einem Brei aus Mennige und Schwefelsäure ausgefüllt. Schließlich wurden die hergerichteten Platten mehrmals geladen und entladen, wodurch die Mennige in Bleisuperoxyd umgewandelt wurde. Die aufgetragene Masse diente vorläufig als aktives Material. Je nach der Beanspruchung der Platte inbezug auf Höhe des Lade- und Entladestromes, sowie der entnommenen Elektrizitätsmenge (Kapazitätsbeanspruchung) wird jede künstlich auf eine positive Bleiplatte aufgetragene Masse früher oder später weich und fällt auf den Boden. Bei den Tudor-Platten war nach 1 bis 2 Jahren die aufgetragene Masse herausgespült. In dieser Zeit aber hatte sich die Bleisuperoxydschicht um so viel weiter aus dem Bleikern entwickelt, daß die Dicke derselben einschließlich der Reste der aufgetragenen Masse, die fest mit der Schicht verwachsen waren, nunmehr genügte, der Platte die von ihr verlangte Kapazität zu geben; die Platte war dann eine reine Planté-Platte.
Da die Platte nach einiger Betriebsdauer als reine Großoberflächenplatte arbeiten sollte, so mußte natürlich, damit die Leistung pro Kilogramm aufzuwendenden Bleimaterials möglichst groß wurde, die Zahl der auf der Flächeneinheit des Kerns stehenden Rippen möglichst gesteigert und die Höhe der Rippen möglichst groß gewählt werden, die Nuten wurden also eng und tief gemacht. Es zeigte[120] sich nun, daß dann die in die Rillen eingetragene Masse nicht mehr schnell genug von der Säure durchdrungen wurde. Infolgedessen blieb von einer gewissen Steigerung der Oberflächenentwickelung ab die gewünschte Mehrleistung aus. Um diesen Übelstand zu beheben, suchte man das Eintragen der aktiven Masse ganz zu vermeiden. Die Platte wird jetzt unter Benutzung eines neuen Verfahrens in der Fabrik so weit formiert, daß sie von vornherein die gewünschte Kapazität hat. Da keine Masse eingetragen wird, so kann die Oberflächenentwickelung wesentlich vergrößert werden.
Fig. 15.
Fig. 15 zeigt den Querschnitt und die bildliche Darstellung der für Beleuchtungsbatterien zur Verwendung kommenden positiven Platten der Akkumulatoren-Fabrik Aktien-Gesellschaft. Die Platte wird ohne Kern hergestellt. a b sind die Längsrippen; sie werden durch Stege c d zusammengehalten. Die Oberflächenentwickelung ist eine achtfache. Die Rippen sind vollständig frei, so daß die Säure gut zirkulieren kann.
Eine zu weit getriebene Oberflächenentwickelung hat, wenn man den Akkumulator, wie es beim Pufferbetrieb der Fall ist, mit relativ hoher Stromdichte beansprucht, einen Nachteil, nämlich, daß der Spannungsabfall in der Säure wächst. Es geht dies aus folgendem Beispiele hervor. Von einer positiven Platte mit achtfacher Oberflächenentwickelung denken wir uns ein Stück von 1 dm Länge und 1 dm Breite als positive Platte in einem Akkumulator; die negative Platte sei gerade so groß; der Abstand der Oberflächen der beiden Platten werde der Einfachheit halber zu 1 cm angenommen; der spezifische Widerstand der Säure sei ρ Ohm (bezogen auf 1 cm3). Der Widerstand, den der Strom in der Säure zu überwinden hat, ist gleich ρ[100]100 Ohm. Die einer glatten Oberfläche von 1 dm2 entsprechende[121] Stromstärke sei i, dann wäre also, wenn der Akkumulator der Oberflächenentwickelung entsprechend ausgenutzt wird, die in Rechnung zu setzende Stromstärke 8i und der durch den Widerstand in der Säure bedingte Spannungsabfall E1 = 8i . ρ100 Volt. Bei einem zweiten Akkumulator sei die Oberflächenentwickelung der positiven Platte eine einfache (glatte Oberfläche ohne Rippen). Soll dieser zweite Akkumulator dasselbe leisten wie der erste, so muß seine positive Platte 8 mal größer sein; bei sonst gleichen Umständen (gleiche Säuredichte, gleiche Größe der negativen Platte wie eben) wäre dann der Widerstand in der Säure 14 . ρ100 (nicht ρ8×100, da der mittlere Säurequerschnitt 4 dm2 ist) und der Spannungsverlust in der Säure E2 = 8i . 14 . ρ100 = 14E1. Wir gelangen also zu dem Resultate, daß eine der Oberflächenentwickelung entsprechende Beanspruchung einen größeren Spannungsabfall zur Folge hat. Dies ist besonders bei Pufferbatterien zu berücksichtigen.
Die genannte Firma verwendet für Pufferbatterien eine mit der in Fig. 15 abgebildeten inbezug auf die Konstruktion übereinstimmende Platte, die aber nur eine 6fache Oberflächenentwickelung hat.
Großoberflächenplatten sollen sich, wie von Fachleuten oft behauptet wird, nicht als negative Platten eignen, da der Bleischwamm keinen festen Halt habe, während das Bleisuperoxyd fest mit dem Bleikern verwächst. In neuerer Zeit jedoch versucht man die Großoberflächenplatten auch als negative Elektroden auszubilden.
Gitterplatten oder pastierte Platten werden als positive und negative Elektroden benutzt. Die Gitter dienen hier dazu, die eingetragene Masse (Füllmasse) festzuhalten und den Strom den einzelnen Teilen zuzuführen. Sie müssen genügende mechanische Festigkeit haben. Die Stromverteilung muß eine möglichst gleichmäßige sein, weil sonst eine ungleichmäßige, den[122] chemischen Umsatz begleitende Volumänderung erfolgt und eine Deformation der Platte (Krümmung), sowie schlechter Kontakt zwischen Träger und aktiver Masse eintreten kann. Je kürzer die Entladedauer, um so enger sollte daß Gitter sein.
Die Paste[101] wird hergestellt aus Mennige (Pb3O4, rot) oder Bleiglätte (Bleioxyd, PbO, gelblichrot) oder aus einer Mischung der beiden Oxyde. Für die Anode wird, um die Formation zu beschleunigen, Mennige, für die Kathode Bleiglätte bevorzugt. Auch Bleimehl kann verwendet werden.
Als Bindemittel verwendet man verdünnte Schwefelsäure, Glyzerinschwefelsäure, d. h. eine Mischung aus Schwefelsäure und Glyzerin, oder Magnesiumsulfatlösung und noch andere Flüssigkeiten. Die Schwefelsäure soll frei sein von Arsenverbindungen, Chlor, Salpetersäure und salpetriger Säure. Wie die Säure auf diese Verunreinigungen hin untersucht wird, werden wir später sehen. Die Paste wird nach sorgfältiger Reinigung der Träger (Gitter) mittels eines eichenen Spatels eingetragen (Schmieren); die pastierten Platten werden in einem mäßig warmen Raume getrocknet. Es verbindet sich die Schwefelsäure während des Trocknens mit Bleiglätte allmählich zu Bleisulfat und die Paste erhärtet infolge Verdunstung des Wassers, die Masse wird porös[102]. Die Mennige verbindet sich langsamer mit der Schwefelsäure,[123] wahrscheinlich unter Bildung von Bleisulfat und Abscheidung von Bleisuperoxyd nach der Gleichung:
Pb3O4 + 2H2SO4 = 2PbSO4 + 2H2O + PbO2.
Fig. 16.
Der Bleischwamm der negativen Platten hat die Neigung, im Laufe der Jahre zusammenzusintern, eine Erscheinung, die man als Schrumpfen oder Verbleiung bezeichnet. Die Masse verliert ihre lockere Struktur, und die Folge ist, daß die Kapazität der negativen Platten allmählich zurückgeht. Um diesem Übelstande zu steuern, mischt man der Masse gewisse Stoffe bei, durch die das Zusammenbacken der Bleischwammteilchen verhindert wird, wie Kaolin, Glaspulver usw. Wird soviel von diesem indifferenten Material beigemischt, daß das Sintern dauernd unmöglich ist, so macht sich ein anderer Übelstand bemerkbar; es tritt nämlich ein so starkes Quellen ein, daß die Masse aus dem gewöhnlichen, alten Gitter herauswächst und als unwirksam zu Boden fallen kann. Dieses kann nun dadurch verhütet werden, daß man die Gitterplatte auf beiden Seiten mit einer perforierten Scheibe aus Hartgummi oder dergl. bedeckt. Die Akkumul.-Fabrik, Akt.-Gesellsch. hüllt ihre aus einem weitmaschigen[124] Gitter bestehende negative Platte in ein mit zahlreichen kleinen Löchern versehenes Bleiblech ein (s. Fig. 16). Das Gitter besteht aus zwei Hälften; jedes wird auf ein perforiertes Blech aufgegossen. Die Massepastillen werden besonders hergestellt und in die eine Gitterhälfte eingelegt. Dann wird die andere Plattenhälfte aufgelegt, und die beiden Hälften werden fest miteinander verbunden. Da die Pastillen also gleichsam in kleinen Kästchen mit perforierter Grund- und Deckfläche liegen, so wird die Platte als Kastenplatte bezeichnet.
Fig. 17.

Gottfried Hagen in Cöln-Kalk verwendet als Anoden und Kathoden Gitterplatten. Dies hat, wie die Firma sagt, den Vorzug, daß die Kapazität beider Plattenarten gänzlich unabhängig von der Sorgfalt bei der Formation wird und stets die gleiche bleiben muß, da alle Platten derselben Art und Größe stets die gleiche Menge wirksamer Bleisalze enthalten. Die viereckigen Gitteröffnungen werden bei den für stationäre Batterien bestimmten Platten um so enger gemacht, je kürzer die Entladedauer oder je größer die Stromdichte bei der Entladung sein soll. Für starke Beanspruchung wird[125] das in Fig. 17 abgebildete Gitter benutzt. Es gleicht in seinem Aussehen den Großoberflächenplatten; es wird aus reinstem Weichblei hergestellt, während die Gitter mit großen Öffnungen (Elektromobile), um genügende mechanische Festigkeit zu erzielen, aus Hartblei (Blei und Antimon) gegossen werden.
Fig. 18.

In neuerer Zeit hat die Firma die negativen Platten wesentlich geändert, und zwar beziehen sich die Änderungen sowohl auf das Gitter wie auf die Zusammensetzung der Masse. Die Beschaffenheit des neuen Gitters ist aus den Figuren 18 und 19 zu ersehen; die letztere zeigt einen Ausschnitt in größerem Maßstabe. Es sind, wie man sieht, außer den nach außen spitz zulaufenden Längsrippen flache, die mechanische Festigkeit erhöhende Bänder vorhanden. Durch die Mitte der Platte (s. Fig. 18) läuft eine starke Leiste, so daß die ganze Platte aus zwei Rahmen besteht.
Fig. 19.

Für transportable Akkumulatoren verwenden die Akkumulatoren- und Elektrizitätswerke Akt.-Ges. vormals W. A. Boese & Co. sogenannte Masseplatten. Diese bestehen aus einem Hartbleirahmen[126] mit einer geringen Anzahl großer Felder (siehe Fig. 20); das Trägergewicht ist also auf ein Minimum reduziert. Die die Felder ausfüllende Masse ist zementartig erhärtet; in jedem Felde befinden sich mehrere kleinere und ein größeres Loch, um den Zutritt der Säure zu den einzelnen Teilen und die Zirkulation zwischen den Platten zu ermöglichen. Besonders bei Entladungen mit längeren Ruhepausen, z. B. bei Telephonbetrieb, erzielt man günstige Leistungen, zumal die Selbstentladung bei solchen Platten eine verhältnismäßig geringe ist[103]. Für Akkumulatoren mit kürzerer Lade- und Entladezeit sind solche Masseplatten nicht geeignet.
Fig. 20.
Formation. Das Verfahren, durch welches auf den Platten eine genügend dicke Schicht von Bleischwamm[127] bezw. von Bleisuperoxyd gebildet wird, nennt man Formation oder Formierung.
Da bei der Formation Schwefelsäure nicht verbraucht wird, es sei denn, daß man zuerst Blei oder die Bleisalze in Bleisulfat verwandeln will, so kann man saure, alkalische und neutrale Lösungen verwenden. Entweder wird die ganze Formation in einer Lösung ausgeführt, oder man behandelt die Platten nacheinander in zwei verschiedenen Lösungen, z. B. zuerst in alkalischer und dann in saurer Lösung. Ferner können Anode und Kathode gleichzeitig in demselben Bade formiert werden, oder es findet eine getrennte Formation statt. Jede dieser Methoden hat ihre Vor- und Nachteile, auf die aber hier nicht eingegangen werden soll.
a) Reine Planté-Formation. Wenn man als Elektroden reine Bleiplatten benutzt und die Zelle lädt, so erfolgt schon nach kurzer Zeit Gasentwicklung. Sobald sich nämlich die positive Platte mit einer sehr dünnen Schicht von Bleisuperoxyd bedeckt hat, hört die Einwirkung des Stromes auf, da das metallisch leitende Superoxyd den darunter liegenden Bleikern vor dem weiteren Angriff des Stromes schützt. Um nun die Kapazität der Elektroden zu vergrößern, lockerte Planté die Platten an der Oberfläche auf, so daß auch unmittelbar unter der Oberfläche liegende Schichten der Stromwirkung zugänglich wurden. Das angewandte Formierungsverfahren war folgendes: Das Element wurde kurze Zeit geladen, dann nach einer Ruhepause entladen, hierauf wieder geladen u. s. f. Bei den verschiedenen Ladungen, deren Dauer wegen der wachsenden Kapazität allmählich größer wurde, schickte er den Strom bald in der einen, bald in der anderen Richtung durch die Zelle, da nur diejenige Elektrode angegriffen und aufgelockert wird, die bei der Ladung Anode ist.
[128]
Inwiefern die Ruhepause von Vorteil ist, zeigten später Gladstone und Tribe. Die Superoxydteilchen bilden mit Bleiteilchen und Säure kleine, kurzgeschlossene Elemente (siehe Selbstentladung). Diese entladen sich während der Ruhepause; hierbei werden Blei und Bleisuperoxyd in Bleisulfat umgewandelt. Bei der nächsten Ladung kann daher eine größere Menge Bleisulfat in Bleisuperoxyd (bezw. in Bleischwamm, wenn die Stromrichtung geändert wird) verwandelt werden.
Die reine Planté-Formation ist umständlich und dauert Wochen, ja Monate lang; sie ist wegen des großen Stromverbrauchs auch teuer.
b) Beschleunigte Formation der positiven Planté-Platten. Schon Planté fand, daß die Formation schneller vor sich geht, wenn man die Platten zuerst in mäßig konzentrierte Salpetersäure eintaucht und dann formiert; durch die Salpetersäure wird die Platte rein chemisch aufgelockert. Die so erhaltene Superoxydschicht fällt aber leicht ab, sie ist nicht so innig mit dem Bleikern verwachsen wie die bei der rein elektrochemischen Formierung entstandene. Auch ist die Gefahr vorhanden, daß Spuren von Salpetersäure trotz sorgfältigen Abspülens der Platte zurückbleiben. Die Elektrode formiert sich dann im Betriebe immer weiter, so daß das Bleigitter oder der Bleikern nach verhältnismäßig kurzer Zeit zerstört wird.
Später sind zahlreiche Vorschläge gemacht worden, um beschleunigte Formation besonders bei den positiven Großoberflächenplatten zu erzielen. Sie bestehen fast alle darin, daß auf rein chemischem Wege Bleiverbindungen gebildet werden, die auf elektrochemischem Wege in Bleisuperoxyd umgewandelt werden. Wird die lösend wirkende Substanz dem Elektrolyten zugesetzt, so[129] spielen sich beide Vorgänge gleichzeitig ab. Epstein behandelt die Bleiplatten in heißer verdünnter Salpetersäure elektrochemisch (s. oben). Eine Platte wird dann zwischen zwei Bleibleche gehängt, die leitend miteinander verbunden sind; der elektrolysierende Strom tritt an der zu formierenden Platte ein.
Nach P. Schoop (l. c. I S. 106) erreicht man am sichersten eine tiefgehende Auflockerung des Bleies bei Verwendung einer Lösung von Natriumbisulfat und Kaliumchlorat. In den Elektrolyten werden drei Bleiplatten aufgehängt, die Außenplatten werden miteinander verbunden usw. (s. oben). Auf der Mittelplatte (Anode) bildet sich eine braune Substanz, die aber kein Bleisuperoxyd ist. Das Chlor wird aus der Platte entfernt, wenn die Substanz zu Bleischwamm reduziert wird. Dies geschieht elektrochemisch in stark verdünnter Schwefelsäure. Die Platten werden sorgfältig mit destilliertem Wasser ausgewaschen, um alles Chlor[104] (Salzsäure) zu entfernen, dann getrocknet und erhitzt. Es bildet sich ein gleichmäßiger und festhaftender Überzug von Bleioxyd; dieses wird durch elektrochemische Formation in verdünnter Schwefelsäure in Superoxyd umgewandelt.
c) Formation der pastierten Platten. α) Negative Platten. Die Füllmasse besteht aus basischem, sowie aus neutralem Bleisulfat und aus nicht zersetztem Bleioxyd. Da sie ziemlich grobkörnig ist und nur zum Teil aus Bleisulfat besteht, so geht dieses nur langsam in Lösung. Infolgedessen wird, wenn man nicht mit sehr geringer Stromdichte arbeitet, der Elektrolyt an Bleisalz oder an Bleiionen bald verarmen. Nimmt aber die Konzentration dieser Ionen in der Nähe[130] der Platte ab, so steigt die Spannung an der Kathode und erreicht bald die für die Wasserstoffabscheidung nötige Höhe. Um die unnütze und auch schädliche Wasserstoffentwickelung zu verhüten, muß man dafür sorgen, daß die Konzentration der Wasserstoffionen eine möglichst kleine oder diejenige der Bleiionen eine möglichst große ist. Da neutrale Salze bei der elektrolytischen Dissoziation keine Wasserstoffionen liefern, so sind neutrale Lösungen für die Formation der negativen Platten vorzuziehen; besonders eignen sich Magnesium- und Aluminiumsulfat (von Fitz-Gerald zuerst ausgeführt, von P. Schoop wieder aufgenommen). Hierbei bildet sich an der negativen Platte gallertartiges Magnesium- bezw. Aluminiumhydroxyd, das aber durch Säure, die bei der Formation (aus der Paste) frei wird, neutralisiert wird. Eine Verarmung des Elektrolyten an Bleiionen — das zweite Mittel, die Wasserstoffentwickelung zurückzudrängen — kann man dadurch erreichen, daß man die Löslichkeit des Bleisulfates steigert, z. B. durch Erwärmung des Elektrolyten[105], oder eine Substanz zusetzt (z. B. Natriumacetat), die mit Blei ein lösliches Salz bildet (Bleiacetat). Von dieser Methode hat man in der Praxis keine Anwendung gemacht, da selbst sehr geringe zurückbleibende Mengen des Zusatzes dem Akkumulator sehr schädlich sind.
Erfolgt die Formation in verdünnter Schwefelsäure zwischen zwei mit einander verbundenen Bleiblechen (Anoden), so dauert sie mehrere Tage.
β) Positive Platten. Die Füllmasse besteht aus Bleisulfat, Bleisuperoxyd (s. S. 123) und Bleiglätte bezw. Mennige. Die Abscheidung der Bleisuperoxydionen,[131] deren Existenz wir annehmen wollen (s. S. 55), muß durch Steigerung der Konzentration dieser Ionen gefördert werden (die Sauerstoffentwickelung also verringert werden). Nun ist die Konzentration dieser Ionen umgekehrt proportional der vierten Potenz der Wasserstoffionen; mithin muß letztere Konzentration auf einer möglichst geringen Höhe gehalten werden. In neutraler Lösung erfolgt also die Formation schneller als in saurer[106]. Man verwendet Aluminium- und Magnesiumsulfat. Während der Formation bildet sich Schwefelsäure, durch deren Dissoziation Wasserstoffionen entstehen; die Säure muß neutralisiert werden; man erreicht dies durch aufgeschwemmtes Magnesium- oder Aluminiumhydroxyd.
[98] Über die verschiedenen Patentansprüche und die historische Entwickelung des Akkumulators siehe Hoppe, Akkumulatoren für Elektrizität, 5. Auflage, ferner P. Schoop, Die Sekundär-Elemente.
[99] Bei Großoberflächenplatten ist das mit dem Bleikern verwachsene Bleisuperoxyd, bei Gitterplatten die ganze eingetragene Masse gemeint.
[100] In Wirklichkeit ist er etwas größer, da ein Teil des Stromes in die Säure innerhalb der Rippen eindringt.
[101] Näheres über die Fabrikation findet man in: F. Grünwald, Die Herstellung der Akkumulatoren, 3. Aufl., 1903. W. Knapp.
[102] M. U. Schoop berechnet in der früher erwähnten Schrift die Porosität einer formierten, gut geladenen Bleisuperoxydplatte (Gitterplatte) zu angenähert 43%, d. h. beträgt der für die Füllmasse zur Verfügung stehende Raum 100 cm3, so sind 43 cm3 mit Säure angefüllt. Für die Bleischwammplatte ergab sich eine noch größere Porosität.
[103] Näheres siehe E. T. Z. 1907, S. 539.
[104] Für Chlor gilt ähnliches wie für Salpetersäure (s. S. 128).
[105] Nicht zu empfehlen, da bei Erwärmung die wirksame Masse zu locker wird.
[106] Eine saure Lösung ist eine solche, in der sich Wasserstoffionen befinden; je größer die Konzentration der H·, um so größer ist die Acidität.
[132]
Aufstellung. Der Raum, in dem die Akkumulatorenbatterie untergebracht wird, soll kühl, trocken und vor allem gut ventilierbar sein, damit die Säure nicht zu stark verdunstet, die Außenwände der Zellen trocken gehalten werden können (Isolation) und die bei der Ladung sich bildenden Gase schnell entweichen. Während der Ladung dürfen brennende oder glühende Körper in dem Akkumulatorenraume nicht geduldet werden, da die Möglichkeit nicht ausgeschlossen ist, daß sich bei schlechter Ventilation eventuell vorhandenes Knallgas entzündet. Zur Beleuchtung dürfen nur elektrische Lampen verwendet werden, die im luftleeren Raume brennen.
Der Fußboden soll fest und solide sein, natürlich muß er auch säurefest sein. Allen Anforderungen dürfte ein Asphaltboden auf Untergrund aus Zementbeton genügen[107].
Die Elemente müssen so aufgestellt werden, daß man zu jeder Zelle freien Zutritt hat zwecks einer Besichtigung,[133] Messung der Säuredichte oder sonstiger vorzunehmender Arbeiten, z. B. Auswechselung defekt gewordener Platten. Daher sollten bei kleineren Zellen nicht mehr als zwei Reihen neben- und übereinander auf demselben Gestelle stehen; größere Zellen müssen auf dem Boden nebeneinander aufgestellt werden. Nach den Vorschriften des Verbandes Deutscher Elektrotechniker müssen die Zellen von Batterien für hohe Spannungen so angeordnet sein, daß bei der Bedienung eine zufällige gleichzeitige Berührung von 2 Punkten, zwischen denen eine Potentialdifferenz von mehr als 250 Volt herrscht, nicht stattfinden kann. Bei Batterien in Anlagen mit mehr als 250 Volt Gebrauchsspannung zwischen 2 Leitern oder mehr als 2 × 250 Volt in Dreileiteranlagen sind nach den Vorschriften des V. D. E. Lattenlaufböden erforderlich. (Isolation gegen Erde.)
Die Gestelle werden aus sorgfältig geteerten oder mit Paraffinöl durchtränkten Balken hergestellt. Der Gebrauch von Nägeln, Schrauben, Bandagen aus Eisen ist zu verwerfen, da diese durch die Säure angegriffen werden; die Verbindung der einzelnen Teile des Gestelles muß daher durch Holzpflöcke geschehen.
Große Sorgfalt ist auf die Isolation zu verwenden, da die Außenseiten der Elemente auch bei guter Bedienung nicht ganz trocken bleiben. Die einzelnen Zellen sind gegeneinander und gegen das Gestell und dieses gegen die Erde durch nichthygroskopische Unterlagen zu isolieren. Bei größerer Batteriespannung kann man Ölisolatoren verwenden, deren oberer Teil größer ist als der untere, so daß etwa herabfließende Säure über den oberen (überhängenden) Teil hinwegtropft, der untere Teil des Isolators also trocken bleibt.
Die im Akkumulatorenraume verlegten Drähte müssen mit säurefester Farbe angestrichen werden. —
[134]
Als Zellen benutzt man Gefäße aus Glas, Zelluloid, Hartgummi und Holz. Glas isoliert gut, ist billig und ermöglicht eine genaue Besichtigung des Inneren des Elementes. Für transportable Akkumulatoren verwendet man Hartgummi oder Zelluloid und versieht die Zellen mit einem Deckel; noch vorhandene Fugen werden mit einem säurefesten und elastischen Kitt verstrichen. Zelluloid soll bei Akkumulatorenbatterien für mehr als 16 Volt Spannung als Material für Gefäße nicht verwendet werden.
Zelluloid ist zwar leicht entzündbar, da aber die Wände von innen durch die Säure gekühlt werden, so wird es nicht leicht vorkommen, daß das Zelluloid bis zur Entzündungstemperatur erhitzt wird. Es hat die Vorzüge, daß es gegen Stöße unempfindlich ist, leicht verarbeitet werden kann und durchsichtig ist; ferner können Gefäße aus diesem Stoffe repariert werden.
Für große Elemente benutzt man Holzkasten, die mit Bleiblech im Innern verkleidet werden. Natürlich dürfen die Platten diese Verkleidung nicht berühren.
Fig. 21.
Einbau. Die Platten werden bei stationären Elementen meistens mittels zweier Fahnen oder Nasen auf dem oberen Rande des Gefäßes aufgehängt (s. Fig. 21), damit sie sich frei ausdehnen können. Die Oberflächen der einzelnen Platten müssen genau parallel laufen, und der Abstand zwischen zwei benachbarten Platten soll in der ganzen Zelle derselbe[135] sein. Hängt nämlich eine Platte schief, so werden die Stellen, die den kleinsten Abstand haben, am stärksten beansprucht, so daß Krümmungen eintreten können; diese können wiederum Abbröckeln der aktiven Masse und Kurzschluß herbeiführen. Hat ferner eine positive Platte von den beiden benachbarten Elektroden ungleichen Abstand, so werden ihre beiden Seiten nicht gleichmäßig ausgenutzt, ebenso nicht die der betreffenden positiven Platte zugewendeten Seiten der negativen Elektroden. Parallelität und gleiche Abstände erreicht man am einfachsten dadurch, daß man zwischen je zwei Platten eine genügende Anzahl von Glasstäben schiebt, die alle denselben Durchmesser haben, und durch elastische Bleistreifen oder Gummipuffer einen seitlichen Druck gegen die Platten ausüben läßt (s. Fig. 21).
Zwischen der unteren Plattenkante und dem Boden des Gefäßes muß sich ein größerer Zwischenraum befinden, in dem sich herabfallende aktive Masse sammeln kann (Vermeidung eines inneren Kurzschlusses).
Fig. 22.
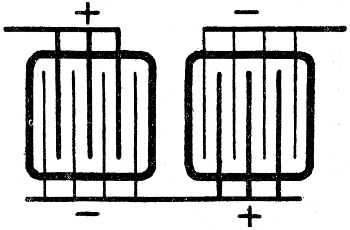
In Fig. 22 ist schematisch dargestellt (für 2 Elemente), wie die Platten angeordnet und mit einander verbunden werden. Warum die erste und letzte Platte einer jeden Zelle negativ sind, wurde früher dargelegt (s. S. 62). Man sieht, daß die positiven Fahnen der ersten Zelle mit den negativen Fahnen der zweiten durch eine Bleileiste verbunden sind. — Bei kleinen Elementen, die nur aus einer positiven und zwei negativen Platten bestehen, verbindet man die beiden letzteren wohl auch durch einen Steg.
[136]
Der Abstand der Platten richtet sich nach deren Größe; einerseits darf er nicht zu groß sein, damit der innere Widerstand der Zelle nicht unnötig groß wird, anderseits darf er nicht so klein sein, daß eine Besichtigung der Platten erschwert oder unmöglich wird; auch kann sich bei geringen Abständen leicht Kurzschluß bilden. Bei kleinen Platten (bis etwa 3 qdm einseitiger Oberfläche) beträgt der Abstand in der Regel 8 bis 10 mm, bei mittelgroßen (bis 6 qdm) 10 bis 12 mm und bei großen 12 bis 15 mm. Bei kleinen transportablen Akkumulatoren sollte der Abstand der Platten reichlich groß gewählt werden, damit Kurzschluß durch herausfallende Masse möglichst vermieden und eine genaue Besichtigung des Innern der Zelle leicht ausführbar ist.
Fig. 23.

Seit einigen Jahren ist man dazu übergegangen zwischen die einzelnen Platten Holzbrettchen oder dergl. zu schieben. Wir haben bereits gesehen, daß man der aktiven Masse der negativen Platten indifferente Substanzen zusetzt, um die Verbleiung zu verhindern. Die aktive Masse quillt dann leicht aus dem Gitter, sie kann herausfallen und Kurzschluß bewirken. Um diesem Übelstande zu steuern, bedeckt die Firma[137] Gottfried Hagen in Cöln-Kalk die negative Elektrode mit einer gelochten Hartgummiplatte, die durch die Glasröhren gegen das Gitter gepreßt wird. Die Perforierung ist eine so feine, daß jedes Durchtreten von Partikeln, die sich loslösen, durch die Öffnungen ausgeschlossen ist und die Säure dennoch leicht zirkulieren kann. Werden Holzkasten für die Zellen verwendet, bei denen Glasröhren keinen Zweck haben, da man ohnehin nicht das Zelleninnere besichtigen kann, so werden Hartgummiplatten verwendet, die auf der einen Seite mit Rippen versehen sind (s. Fig. 23); diese vertreten die Stelle der Glasröhren.
Fig. 24.
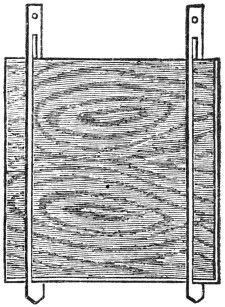
Nach den Montagevorschriften der Akkumulatoren-Fabrik Aktien-Gesellschaft werden zwischen die einzelnen Platten Holzbrettchen geschoben, die etwas größer sind als die Platten. Die Brettchen werden in die Schlitze von Holzstäben geschoben (siehe Fig. 24). Diese sind etwas dünner als die Plattenzwischenräume und sitzen anfangs etwas lose. Da die Stäbe in der Säure quellen, so sitzen sie bald fest. Auf diese Weise wird erreicht, daß zwischen Platten und Brettchen ein enger Zwischenraum ist und die aktive Masse mit einer genügend großen Menge von Säure in Berührung ist. Die Brettchen erfahren eine besondere Vorbehandlung in der Fabrik, und es sollen (infolgedessen?) aus dem Holz Stoffe in Lösung treten, die ein Sulfatieren der Platten fast unmöglich machen, so daß die Kapazität lange bleibt. Die Wirksamkeit der Brettchen soll, da die betreffenden Stoffe sich nur langsam ausscheiden,[138] für lange Jahre vorhalten. Außerdem dienen die Brettchen auch als Mittel zur Verhinderung von Kurzschluß.
Es empfiehlt sich, die Zellen mit Glasplatten zu bedecken, weil dann Säurepartikelchen, die beim „Kochen‟ durch die Gase mitgerissen werden, zurückgehalten werden und verhindert wird, daß von der Decke abbröckelnder Kalk oder dgl. in die Säure fällt.
Für die Elemente der Automobilbatterien werden Hartgummikasten verwendet. Die Platten werden auch mit Zwischenlagen aus perforiertem Hartgummiblech oder aus Holzbrettchen eingebaut. Die einzelnen Elemente werden so miteinander verbunden, daß schadhafte Zellen leicht ausgewechselt werden können; man benutzt biegsame Verbindungen aus Bleistreifen oder verbleiten Kupferstreifen, die beiderseits durch Schrauben befestigt werden.
Säure. An die Reinheit der Schwefelsäure und des zum Nachfüllen zu benutzenden Wassers sind, wie sich aus früheren Betrachtungen (s. S. 107 und S. 110) ergeben dürfte, die höchsten Anforderungen zu stellen. Sie müssen vor allem frei sein von metallischen Verunreinigungen. Fremde Metalle (s. Selbstentladung) bewirken das sogen. Nachgasen. Man prüft die Säure auf die Anwesenheit schädlicher Metalle dadurch, daß man mittels eines sauberen Holzspans ein Stückchen Zink in eine Probe bringt, die sich in einem Reagenzglas befindet. Sind schädliche Metalle in der Säure, so bilden sich Lokalelemente, und es wird elektrolytisch Wasserstoff abgeschieden, man sieht beständig feine Gasbläschen emporsteigen. Der Versuch, der etwa 1⁄2 Stunde dauern sollte, wird 3mal wiederholt; bleibt einmal die stetige Bläschenbildung aus, so ist die Säure frei von schädlichen Metallen.
[139]
Der Elektrolyt muß ferner frei sein von Chlor, Salpetersäure und salpetriger Säure, Arsenverbindungen und Essigsäure. Auch ganz minimale Mengen dieser Substanzen sind dem Akkumulator sehr schädlich; sie wirken nämlich zerstörend auf den Bleikern, indem sie Blei lösen. Die Bleiverbindung wird durch den Strom zersetzt und die Verunreinigung wird wieder frei usw. (s. Formation).
Untersuchung auf Salpetersäure: Man löst etwas Brucin in konzentrierter Schwefelsäure und setzt der Schwefelsäureprobe einige Tropfen der Lösung zu. Bei Gegenwart auch der geringsten Menge Salpetersäure erfolgt Rotfärbung.
Stickstoffverbindungen können auch in der Weise nachgewiesen werden, daß man in Wasser eine gleiche Menge konzentrierter Schwefelsäure eintropfen läßt und der heißen Lösung etwas Indigolösung zusetzt. Wird die Flüssigkeit entfärbt, so ist die Säure nicht brauchbar.
Die Untersuchung auf Chlor ist mit besonderer Sorgfalt auszuführen. 5 cm3 (ca. 9 Gramm) Säure werden mit 50 cm3 destilliertem Wasser gemischt[108]; nach 5-6 Stunden setzt man etwas Salpetersäure und 20prozentige Silbernitratlösung (Höllensteinlösung) zu. Nach einstündigem Stehen darf die Flüssigkeit keine weiße Färbung, höchstens ganz schwaches Opalisieren zeigen. (Es bildet sich bei Gegenwart von Chlorverbindungen unlösliches, weißes Chlorsilber.)
Arsenverbindungen werden durch eingeleiteten Schwefelwasserstoff in braunes, unlösliches Schwefelarsen umgewandelt.
Zum Füllen der Elemente benutzt man verdünnte Schwefelsäure vom spezifischen Gewichte 1,15 bis 1,17; sind die Positiven Großoberflächenplatten, so kann die Säure etwas stärker sein. Die Dichte der Säure wird bei den ersten Ladungen etwas größer, da die Paste noch weiter formiert wird und hierbei Schwefelsäure frei wird. — Da bei der Vermischung von Schwefelsäure und Wasser eine starke Wärmeentwickelung erfolgt und explosionsartige Erscheinungen auftreten, wenn man[140] Wasser in Schwefelsäure gießt, so muß man die Schwefelsäure in dünnem Strahle unter Umrühren dem Wasser zusetzen. Mittels des Aräometers konstatiert man, ob die Mischung das gewünschte spezifische Gewicht hat. Erst nach dem Erkalten darf die Säure in die Akkumulatorengefäße gegossen werden. Muß man einen Trichter benutzen, so verwende man einen solchen aus Glas oder Porzellan.
Da die Untersuchung der Schwefelsäure und die Herstellung der Mischung umständlich ist, so empfiehlt es sich, die Säure durch die Akkumulatorenfabrik oder durch Handlungen zu beziehen, die von der Akkumulatorenfabrik empfohlen werden.
Die Säure soll die oberen Kanten der Platten mindestens 1 cm überragen; vor allem darf es nicht vorkommen, daß der obere Teil der Platten aus der Säure herausragt. Im Laufe der Zeit ändert sich die Menge und die Dichte der Säure, da Wasser verdampft, kleine Säureteilchen von den bei der Ladung sich bildenden Gasblasen mitgerissen werden und die Kapazität der Platten zu- bezw. abnehmen kann; wächst diese im Laufe der Zeit, so wird bei der Entladung mehr Säure verbraucht und die Schwankungen der Säuredichte werden größer. Meistens genügt es, durch Zusatz von destilliertem Wasser[109] die Säure auf die richtige Höhe zu bringen; von Zeit zu Zeit jedoch muß man die Säuredichte der einzelnen Zellen sowohl im vollständig geladenen wie im vollständig entladenen Zustande messen und eventuell Akkumulatorensäure hinzufügen (nie konzentrierte Säure, da diese die Platten angreift). Man setzt am besten die Säure vor Beginn[141] der Ladung zu, indem die Gasblasen eine Vermischung bewirken. Im entladenen Zustande beträgt die Säuredichte meist 1,15, im geladenen Zustande kann sie bis 1,20 betragen. Eine zu niedrige Säuredichte schadet übrigens dem Akkumulator nicht, wohl aber eine zu hohe (Begünstigung der Sulfatierung, Verringerung der Lebensdauer). Säure, die beim Nachfüllen verschüttet wird, ist sofort abzuwaschen, damit die Isolatoren trocken bleiben.
Die Säuredichte mißt man mittels eines Aräometers, dessen Körper so flach ist, daß man es in den engen Zwischenraum zwischen den Platten einführen kann. Sind die Zellen mit einem Deckel versehen, so benutzt man ein Aräometer mit Saugheber und Gummiball. Bei genauen Untersuchungen ist zu beachten, daß die Säure in der Nähe des Gefäßbodens etwas konzentrierter ist. Durch Einblasen von Luft kann man eine Vermischung herbeiführen.
In der folgenden Tabelle ist das spezifische Gewicht, das Mischungsverhältnis und der Widerstand von 1 cm3 verdünnter Schwefelsäure angegeben.
| Spezifisches Gewicht bei 15° |
Gewichts- prozente H2SO4 |
Grade Baumé |
Widerstand eines Kubikcent. (angenähert) |
||||||
|---|---|---|---|---|---|---|---|---|---|
| 1, | 10 | 14, | 35 | 13, | 0 | 2, | 2 | Ohm | (Minimum) |
| 1, | 12 | 17, | 01 | 15, | 4 | 1, | 8 | „ | |
| 1, | 14 | 19, | 61 | 17, | 7 | 1, | 6 | „ | |
| 1, | 16 | 22, | 20 | 19, | 8 | 1, | 5 | „ | |
| 1, | 18 | 24, | 76 | 22, | 0 | 1, | 45 | „ | |
| 1, | 20 | 27, | 32 | 24, | 0 | 1, | 4 | „ | |
| 1, | 22 | 29, | 84 | 26, | 0 | 1, | 38 | „ | |
| 1, | 224 | 30, | 50 | 26, | 6 | 1, | 36 | „ | |
Zuweilen verwendet man für die Füllung transportabler Akkumulatoren gelatinöse Schwefelsäure,[142] die aus Schwefelsäure, Wasserglas und Asbest hergestellt wird. Die Trockenfüllung leidet an den Nachteilen, daß der innere Widerstand des Elementes stark erhöht und die Kapazität wesentlich verringert wird. Die Füllung muß mit einer Schicht flüssiger Säure von etwa 5 mm Dicke bedeckt sein, ev. ist destilliertes Wasser oder stark verdünnte Säure zuzusetzen.
Für Automobilbatterien verwendet man, da man die Säuremenge, um das Gewicht zu verringern, möglichst klein macht, Säure von etwas höherer Konzentration als bei Zellen für stationäre Anlagen; im geladenen Zustande darf die Säuredichte den Wert 1,25 erreichen.
Muß eine Zelle geleert werden, so zieht man die Säure mittels eines Hebers ab; die Platten werden in destilliertem Wasser aufbewahrt. Die betreffende Zelle muß, nachdem sie neu montiert ist, stark überladen werden. Zu dem Zwecke schaltet man sie während der Ladung der Batterie mit den anderen Zellen in Reihe, man verbindet sie also mit den beiden benachbarten Zellen. Nach Beendigung der Ladung wird eine der beiden Verbindungen beseitigt und der positive Pol des einen Nachbars mit dem negativen Pole des anderen verbunden (Überbrückung). Unsere Zelle ist also während der Entladung der Batterie ausgeschaltet. Bei der folgenden Ladung wird sie wieder mitgeladen usw.
Die Vorschriften für die Ladung und Entladung weichen in einzelnen Punkten bei den verschiedenen Firmen voneinander ab, was ja schon durch den Umstand erklärt werden kann, daß die Fabrikate verschieden sind. Die folgenden Vorschriften dürften aber allgemein gültig sein.
Die erste Ladung (nach der Montage) soll, wenn eben möglich, ohne Unterbrechung so lange fortgesetzt werden, bis bei allen Zellen an beiden Elektroden reichlich[143] Gas entwickelt wird. Ihre Dauer ist eine große (24-48 Stunden), da die aktive Masse, besonders bei den negativen Platten, an der Luft (während des Transportes, der Montage) verändert wird, so daß eine nachträgliche Formierung erfolgen muß. Am längsten dauert natürlich die erste Ladung, wenn die negativen Platten unformiert versandt wurden.
Die späteren Ladungen sollen, wenn möglich sofort, spätestens aber 24 Stunden nach Beendigung der Entladung erfolgen (s. Sulfatierung). Falls die Batterie stark erschöpft ist, was bei Betriebsstörungen, z. B. bei einer Reparatur der Dynamo, vorkommen kann, so muß sofort gründlich aufgeladen werden. Zu beachten ist, daß man den positiven Pol der Batterie mit dem positiven Pole der Stromquelle verbinden muß (ev. Polreagenzpapier benutzen). Der maximale Ladestrom (gewöhnlich gleich der maximalen Entladestromstärke) darf nicht überschritten werden. Man lädt so lange, bis bei sämtlichen Elementen der Batterie an beiden Elektroden lebhafte Gasentwicklung erfolgt. Der Wärter hat die Pflicht, bei jeder Ladung nachzusehen, ob alle Zellen gasen[110].
Finden täglich mehrere Teilladungen statt, so darf nur eine bis zur vollen Gasentwicklung durchgeführt werden, die anderen dagegen sind sofort abzubrechen, wenn an einer Elektrode Gasentwicklung beginnt.
Will man (im Laboratorium) große und kleine Zellen gleichzeitig laden, so schaltet man zwei oder mehrere der kleinen Zellen parallel, bildet aus diesen gleichsam einen größeren Akkumulator, oder man wählt den Strom so, daß er der kleinsten Type angepaßt ist.
[144]
Es ist darauf zu achten, daß die mit dem Zellenschalter verbundenen Elemente nicht zu lange überladen werden.
Auch dann, wenn eine Batterie nicht oder nur wenig benutzt wird (Laboratorium), muß von Zeit zu Zeit, etwa alle 14 Tage, aufgeladen werden (siehe Selbstentladung). Automobilbatterien sollen nach jeder Fahrt geladen werden.
Die Ladestromstärke darf, wie wir bereits sahen, eine gewisse Größe nicht überschreiten; sie ist, wenn an beiden Platten Gasentwicklung erfolgt, auf etwa die Hälfte des ursprünglichen Wertes herabzusetzen. Hierfür kann man verschiedene Gründe angeben. Wird die Gasentwicklung zu stürmisch, so werden viele kleine Partikelchen der wirksamen Masse losgesprengt. Ferner hat die Elektrodenspannung, wenn die Stromstärke nicht vermindert wird, einen hohen Wert, und es kann sich Überschwefelsäure bilden (s. S. 14). Auch wird bei starker Gasentwicklung zu viel Säure verspritzt.
Bei Lichtanlagen arbeiten die Dynamo und Batterie parallel. Die Ladung der Batterie muß, ehe der Parallelbetrieb beginnt, beendet sein, ein Nachladen bei ausgeschaltetem Ladeschalter ist unter allen Umständen zu vermeiden, weil es zu einer Schädigung der mittleren Schaltzellen führt.
Wir wollen uns dies an einem bestimmten Falle klar machen. Es handle sich um eine Lichtanlage, bei der die Spannung in der Zentrale 115 Volt beträgt. Es sind 115:1,8 = 64 Zellen erforderlich; von diesen seien 12 mit dem Doppelzellenschalter Verbunden. Die Ladung sei soweit fortgeschritten, daß die Spannung jeder Zelle 2,2 Volt beträgt. Dann werde zum Parallelbetrieb übergegangen. Die Ladung kann nur durch den Entladeschalter geschehen (s. S. 173). Es können dann nur 115:2,2 = 52 Zellen Strom bekommen, die 12 letzten Zellen werden also nicht mit geladen. Muß die Batterie später[145] Strom abgeben, so sind anfänglich 115:2 = 58 Zellen an der Stromlieferung beteiligt. Die Zellen 53 bis 58 werden also überanstrengt, da sie bei der Nachladung keinen Strom erhielten.
Die Akkumulatoren-Fabrik Akt.-Ges. schreibt für ihre Batterien vor, daß unter normalen Verhältnissen etwa alle 3 Monate eine Ladung mit Ruhepausen erfolgen soll (s. S. 114). Durch diese sucht man offenbar einer beginnenden Sulfatation vorzubeugen. Die Ladung geschieht in der Weise, daß die Maschine abgeschaltet wird, sobald an beiden Elektroden die Gasentwicklung beginnt; die Batterie ist vom Netze zu trennen. In diesem Ruhezustande soll sie mindestens 1 Stunde stehen bleiben. Dann wird wieder geladen bis zur Gasentwicklung, wieder abgeschaltet etc. Ladungen und Ruhepausen sollen solange aufeinander folgen, bis sofort nach dem Einschalten der Maschine Gasentwicklung beginnt. Bei den Nachladungen soll die Stromstärke natürlich kleiner als die normale sein. Dasselbe Verfahren soll angewandt werden, wenn die Batterie zu stark beansprucht und wenn sie wiederholt ungenügend geladen worden ist.
Zellen, die voraussichtlich längere Zeit nicht benutzt werden, sind gründlich aufzuladen (Selbstentladung); besonders schnell geht die Selbstentladung bei Großoberflächenplatten vor sich.
Der Wärter hat die Pflicht, alle Zellen bei jeder Ladung zu beobachten; besondere Aufmerksamkeit soll er den Schaltzellen zuwenden. Es kommt zuweilen vor, daß eine Zelle gegen die anderen zurückbleibt[111]; es erfolgt keine Gasentwicklung, wenn die Nachbarn schon lange „kochen‟, die Säuredichte steigt[146] nicht oder doch nur sehr langsam an. Eine solche Zelle ist auf Kurzschluß zu untersuchen. Ein solcher kann verursacht werden dadurch, daß sich eine Platte krümmt oder dadurch, daß ein Fremdkörper in die Zelle hineinfällt oder daß aktive Masse aus dem Gitter herausfällt. Er hat zur Folge, daß der Ladestrom sich verzweigt und nur ein Bruchteil des Stromes durch die Säure fließt, d. h. eine elektrochemische Wirkung ausübt. Nach der Ladung entlädt sich die Zelle in sich selbst; denn der den Kurzschluß bewirkende Körper bildet eine leitende Verbindung zwischen den beiden Polen. Bei einer solchen Zelle tritt bald Sulfatierung ein, die mit einer Kapazitätsabnahme verbunden ist.
Das Vorhandensein eines Kurzschlusses kann man mittels eines kleinen Kompasses feststellen. Diesen legt man nacheinander zwischen zwei benachbarte Fahnen; kommt man an eine Platte, die Kurzschluß hat, so wird die Nadel durch das magnetische Feld des Stromes abgelenkt.
Die Vorschriften für die Entladung sind größtenteils schon in den Betrachtungen des Kapitels 4 enthalten. Es sei daran erinnert, daß eine gewisse Stromstärke nicht überschritten werden darf. Dies ist besonders beim Experimentieren im Laboratorium etc. zu beachten. Ist man im Zweifel, wie stark der Strom bei einem Versuche wird, so muß man einen Rheostaten und ein Ampermeter mit einschalten, wie es in Fig. 25 angedeutet ist. In dieser soll A den Apparat darstellen, dem Strom zugeführt wird, Amp. ein Ampermeter, W einen veränderlichen Widerstand, B die Batterie, Voltm. ein Voltmeter.
[147]
Die Frage, woran man erkennt, ob ein Akkumulator entladen ist, hat große praktische Bedeutung (man vergleiche die Bemerkungen auf S. 102 und die Darlegungen über die Erholung). Weiß man nicht bestimmt, ob man einer Zelle noch Strom entnehmen darf, so verbindet man die Klemmen mit einem Voltmeter und läßt das Element den der dreistündigen Entladung entsprechenden Strom abgeben. Ist die Zelle erschöpft, so sinkt die Klemmenspannung in kurzer Zeit auf 1,8 Volt. — Dauert ein Versuch längere Zeit, so sollte stets ein Voltmeter mit den Klemmen des Elementes bezw. der Batterie verbunden sein (Schaltung s. Fig. 25).
Fig. 25.
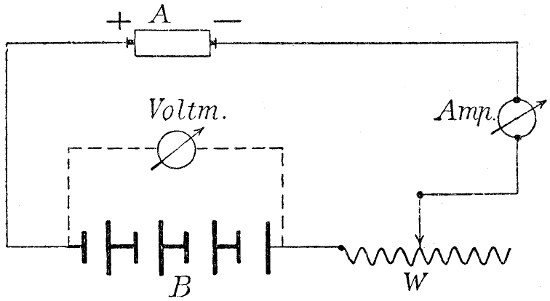
Um zu prüfen, wie groß noch ungefähr die Elektrizitätsmenge ist, die man entnehmen darf, kann man das Aräometer benutzen. Kennt man die Säuredichte der Zelle in geladenem und entladenem Zustande, so kann man aus dem augenblicklichen spezifischen Gewichte einen Schluß über den Energieinhalt ziehen. Weiß man z. B., daß die Säuredichte des vollgeladenen Elementes 1,20 und diejenige der entladenen Zelle 1,16 ist, und findet man, daß das spezifische Gewicht den Wert 1,17 hat, so enthält der Akkumulator noch ungefähr 3⁄4 seiner Elektrizitätsmenge.
Elemente, die sehr selten oder nie ganz entladen werden, gehen in ihrer Kapazität zurück. Soll dies vermieden werden, so müssen die Zellen von Zeit zu Zeit, etwa alle 4-5 Wochen einmal, mit möglichst[148] der garantierten Kapazität beansprucht werden. Diese Vorschrift ist besonders für solche von Wichtigkeit, die Anlagen in Schulen etc. zu beaufsichtigen haben.
Sulfatieren, Krümmen. Bei Batterien macht sich stärkere Sulfatierung in einer oder mehreren Zellen in der Weise bemerkbar, daß bei der gewöhnlichen anfänglichen Ladespannung nur ein schwacher Strom zustande kommt. Um die schadhafte Zelle herauszufinden, mißt man die Spannung der Elemente einzeln mittels eines Voltmeters für geringe Spannungen (Taschenvoltmeter bis 3 Volt); in stromlosem Zustande ist die Klemmenspannung der betreffenden Zelle sehr klein. Bei der Ladung kann in der kranken Zelle Gasentwicklung erfolgen, ohne daß ein chemischer Umsatz an den Platten erfolgt.
Bedeckt das kristallinische Bleisulfat noch nicht die ganze Oberfläche, oder ist es nur in sehr dünner zusammenhängender Schicht vorhanden, so gelingt es meistens, die Zelle unter Anwendung einer höheren Spannung (3-4 Volt) aufzuladen. (Im Laboratorium benutzt man am besten die Thermosäule; bei größeren Batterien kann man den Ladestrom den Schaltzellen entnehmen.) Während der Ladung schalte man ab und zu (etwa nach je 10 Minuten) eine Ruhepause (5-10 Minuten) ein (S. 114). Nach der ersten Ladung hat das Element noch nicht seine volle Kapazität. Man behandelt daher die Zelle in der früher angegebenen Weise.
Die Sulfatierung ist in der Regel mit einem Krümmen der Platten verbunden. Findet man, daß eine Platte die Neigung zum Werfen hat, so schiebt man zwischen sie und die benachbarte Platte Glasstäbe, so daß eine weitere Verringerung des Plattenabstandes nicht erfolgen kann, oder man drückt die Platte durch[149] breite flache Hölzer, deren Dicke gleich dem Plattenabstand ist, gerade. Gelingt dies nicht, so ist die Platte durch eine neue zu ersetzen. Die Kölner Akkumulatoren-Werke schreiben vor, daß in Zellen, die dauernd zu arbeiten haben, Platten aus der letzten Schaltzelle kommen, also Platten, die gut durchgearbeitet sind, während die neuen Platten in die Schaltzellen eingesetzt werden.
Damit man beginnende Krümmung oder andere Fehler entdeckt, muß man von Zeit zu Zeit eine Revision sämtlicher Zellen vornehmen. Man bedient sich hierbei, besonders wenn es sich um große Zellen oder um Elemente in Holzkästen handelt, einer Ableuchtlampe, d. h. einer elektrischen Lampe mit Schutzkorb, Schutzglas, einer Schlauchleitung und einem Stöpsel für Wandkontakt[112].
Automobilzellen sind von Zeit zu Zeit, unter normalen Verhältnissen alle drei Monate, zu reinigen. Die Plattensätze werden zu dem Zwecke, nachdem die Batterie entladen ist, zusammen mit dem Deckel vorsichtig aus den Kasten herausgehoben, durch mehrmaliges Heben und Senken in destilliertem Wasser abgespült; die Kasten werden entleert und gereinigt, dann werden die Plattensätze wieder eingeschoben und Säure vom spez. Gew. 1,16-1,17 zugesetzt. Nach jeder Reinigung muß eine gründliche Aufladung mit etwa dem halben normalen Ladestrom erfolgen.
Im Übrigen sei bemerkt, daß die Firmen genaue Vorschriften über die Behandlung der von ihnen gelieferten Batterien geben und daß sie gegen eine jährliche[150] Prämie die Überwachung und Instandhaltung der Batterien übernehmen (Akkumulatorenversicherung).
Die Lebensdauer des Akkumulators hängt in hohem Maße von der Art der Behandlung ab. Über diese können allgemein gültige Angaben kaum gemacht werden. Dünne Platten, wie sie für Traktionszwecke benutzt werden, die mit relativ hoher Stromdichte beansprucht werden, müssen nach 100 bis 200 Entladungen ausgewechselt werden. Planté-Platten haben eine andere Widerstandsfähigkeit als Faure-Platten. Auch spielt die Art der Formation eine wichtige Rolle; eine zu stark beschleunigte Formierung scheint die Lebensdauer ungünstig zu beeinflussen.
Werden bei der Formation dem Elektrolyten Chemikalien zugesetzt, die Blei chemisch angreifen, so kann es leicht vorkommen, daß in den Platten geringe Mengen dieser Substanzen zurückbleiben und in die Akkumulatorensäure gelangen. Das Blei des Trägers wird im Laufe der Zeit „angefressen‟, so daß die mechanische Festigkeit immer kleiner wird.
Die Lebensdauer der positiven Platten ist durch die Zeit gegeben, bis zu welcher das Blei der Rippen und des Kerns durch Umwandlung in Superoxyd aufgebraucht wird (s. Lokalaktion, S. 110); die mechanische Festigkeit der Platten wird geringer und ihr Widerstand größer. Daraus ergibt sich, daß die Menge des festen Bleies in hohem Grade maßgebend ist für die Lebensdauer der positiven Platten.
Bei älteren negativen Platten geht der Bleischwamm langsam in festes, dichtes Blei über, er schrumpft unter[151] beträchtlicher Volumänderung zusammen; es bilden sich Risse, und der Zusammenhang zwischen der Unterlage und der aktiven Masse wird gelockert. Man nennt diese Erscheinung Schrumpfen, Sintern, Verbleiung. Sie ist natürlich mit einer Kapazitätsabnahme verbunden, da die Säure nicht mehr in das Innere eindringen kann. Durch Zusatz gewisser indifferenter Substanzen (z. B. Koks, Bimsstein) in fein verteiltem Zustande zu dem Breie, den man in die Gitter schmiert, soll das Sintern verhindert bezw. verlangsamt werden (s. S. 136).
Durch zu starke Beanspruchung der negativen Platten wird das Schrumpfen beschleunigt. Daher dürfte ein weiteres Mittel, dem Verbleien vorzubeugen, darin bestehen, die Kapazität der Bleischwammplatten von vornherein größer zu wählen als die der positiven Elektroden.
Vor allem muß sich jeder, der Akkumulatoren benutzen will, mit den Vorgängen im Akkumulator und mit seinen Eigentümlichkeiten genau bekannt machen und sich von vornherein daran gewöhnen, mit der nötigen Vorsicht zu Werke zu gehen.
[107] Siehe Zentralblatt für Akkumulatorentechnik 1907, S. 30 oder E. T. Z. 1907, S. 611.
[108] Das betr. Glas ist mit destilliertem Wasser gut auszuspülen.
[109] Das destillierte Wasser ist auf Chlor zu untersuchen, s. S. 139.
[110] Alle Zellen mit Ausnahme der Schaltzellen müssen zu gleicher Zeit und gleichmäßig zur Gasentwicklung gelangen.
[111] Ist ein Doppelzellenschalter vorhanden, so können zurückgebliebene Schaltzellen in der Weise nachgeladen werden, daß man sie zwischen Lade- und Entladehebel nimmt. Durch diese Zellen geht dann der ganze von der Dynamo abgegebene Strom, der natürlich den maximalen Ladestrom nicht überschreiten darf. Bei anderen Zellen wendet man die Überbrückungsmethode an (s. S. 142).
[112] Zum Reinigen der Akkumulatoren kann man einen Apparat benutzen, der zum Absaugen des Schlammes dient. Er besteht aus einer Luftpumpe und Vakuumkessel, an dem ein Schlauch mit passendem Bleimundstück angeschlossen ist Man zieht zuerst die Säure ab, saugt dann den Schlamm ab und füllt wieder ein. Das Herausnehmen der Platten ist also überflüssig.
[152]
An den Bleiakkumulatoren wird als ein Nachteil getadelt, daß sie ein im Vergleich zu ihrer Leistung großes Gewicht haben. Dieses ist in erster Linie bedingt durch das hohe spezifische Gewicht und das große elektrochemische Äquivalent des Bleies. Auch der Umstand, daß Blei ein weiches Metall ist, wäre hier zu erwähnen. Der Träger der aktiven Masse muß nämlich aus Blei bestehen, die Platten müssen, damit sie genügend fest sind, eine ziemlich große Dicke haben. Endlich ist der Bleiakkumulator auch deshalb ein schwerer Akkumulator, weil der Elektrolyt in verhältnismäßig großer Menge vorhanden sein muß. Denn die Säure ist an dem chemischen Umsatze beteiligt, so daß man gezwungen ist, pro Amperstunde eine gewisse Säuremenge zu verwenden. Wird die Säure knapp bemessen, so sinkt ihre Dichte während der Entladung stark; dies hat zur Folge, daß der innere Widerstand größer und die elektromotorische Kraft kleiner wird. Nimmt man wenig, aber ziemlich stark konzentrierte Säure, so wird die Sulfatierung begünstigt und die Lebensdauer verringert. Das Gewicht der Säure beträgt bei stationären Akkumulatoren etwa 20% des Gesamtgewichtes. Was das Gewicht der Platten anbelangt, so[153] kann man durch Verringerung der Dicke das Verhältnis zwischen Leistung und Gewicht wesentlich verbessern. Eine derartige Steigerung der Leistung pro Kilogramm Zellengewicht wird aber nur auf Kosten der Lebensdauer erkauft. Nach E. Sieg[113] haben Zellen der Kölner Akkumulatorenwerke für Traktionszwecke (Automobile), die ca. 30 Wattstunden pro Kilogramm geben, als mittlere Lebensdauer nur ca. 100 Entladungen.
Es gibt nun zwei Möglichkeiten, einen leichteren Akkumulator zu konstruieren, nämlich erstens Metalle zu verwenden, deren spezifisches Gewicht und elektrochemisches Äquivalent kleiner ist als bei Blei[114], zweitens das Elektrodenmaterial und den Elektrolyten so zu wählen, daß der Elektrolyt bei Stromzufuhr und Stromentnahme seine Konzentration nicht ändert.
Nach beiden Richtungen hin sind von zahlreichen Erfindern schon seit mehr als 20 Jahren Versuche angestellt worden.
Verdünnte Schwefelsäure hat folgende wertvolle Eigenschaften: 1. sie leitet den elektrischen Strom sehr gut (natürlich im Vergleich zu anderen Elektrolyten), 2. sie verändert sich an der Luft nicht, 3. sie bleibt in dem Gefäße, in dem sie sich befindet, sie kriecht nicht, wie es viele andere Lösungen tun, an den Wänden langsam empor. Will man an der Verwendung der verdünnten Schwefelsäure für einen Sammler festhalten, so hat man unter den Metallen keine große Wahl, da sich die meisten bezw. ihre Oxyde in diesem Elektrolyten lösen.
Beachtung verdient hier vor allem das Kupferoxyd-Zink-Element (Lalande, Edison, Wedekind), das als Vorläufer des Edison-Akkumulators bezeichnet werden kann. Als Elektrolyt dient Natron- oder Kalilauge. Das Kupferoxyd verliert während der Entladung[154] seinen Sauerstoff, das Zink geht als Zinkhydroxyd in Lösung. Das entstandene poröse und schwammige Kupfer nimmt an der Luft, besonders wenn es erhitzt wird, Sauerstoff auf.
Wir wenden uns jetzt zu dem Hauptgegenstande dieses Kapitels, nämlich zu dem Edison-Akkumulator. Darrieus[115] beschäftigte sich vor etwa 18 Jahren schon mit der Herstellung eines Akkumulators, bei dem an Stelle des schweren Bleies andere Metalle und als Elektrolyt Kali- oder Natronlauge benutzt werden sollten. Unter den Metallen, die er aufzählt, befinden sich auch Eisen, Nickel, Kadmium. Im Jahre 1899 wurde dem Schweden Jungner ein Patent erteilt, das sich auf einen alkalischen Akkumulator mit Silber- und Kupferelektroden bezieht. Die Versuche erstreckten sich aber auch auf Eisen, Nickel und Kadmium. Es sind etwas mehr als 8 Jahre her, als Dr. Kenelly die Aufmerksamkeit der ganzen Welt auf eine neue Erfindung Edisons lenkte, nämlich auf ein Element, das nach den Nachrichten, die zu uns gelangten, berufen zu sein schien, dem biederen Bleiakkumulator den Todesstoß zu versetzen. Die ersten Zellen, die D-Zellen, kamen i. J. 1903 nach Europa. Aber sie wurden schon nach kurzer Zeit vom Markte zurückgezogen. Später wurde die Fabrikation der H-Zellen in großem Maßstabe aufgenommen, auch in Berlin (Deutsche Edison-Akkumulatoren-Company). Diese wird im Folgenden ausführlich besprochen werden.
Edison hatte sich die Aufgabe gestellt, einen Akkumulator herzustellen, der nicht nur pro Wattstunde ein geringeres Gewicht als der Bleiakkumulator haben sollte, sondern auch gegen schlechte Behandlung unempfindlich[155] sein sollte. Inwiefern es Edison gelungen ist, dieses Ziel zu erreichen, werden wir später sehen.
Vorgänge in der Edison-Zelle. Die wirksame Masse der positiven Elektrode besteht aus Nickelhydroxyd, Ni(OH)2, dem etwa 20% eines flockigen Graphits zugesetzt werden. Der Graphitzusatz bewirkt nicht nur eine Verbesserung der Leitfähigkeit der aktiven Masse, sondern er verhindert auch ein Aufschwemmen der Masse bei der Ladung; in erster Linie aber soll seine Bedeutung darin liegen, daß er trotz der starken Pressung der Masse (s. unten) eine gewisse Porosität gewährleistet. Als negatives Elektrodenmaterial wird Eisenhydroxyd verwendet, dem ca. 10% Quecksilberoxyd beigemischt werden. Letzteres dient dazu, die Leitfähigkeit der Masse zu verbessern, und soll dazu beitragen, die Zelle gegen starke Stromstöße unempfindlich zu machen. Welche Vorgänge sich in der Zelle bei Stromdurchgang abspielen, steht noch nicht mit Sicherheit fest. Nach Elbs[116] wird das Eisenhydroxyd durch Wasserstoff zu Eisen reduziert, während Nickelhydroxyd durch OH (hervorgegangen aus OH-Ionen) auf eine höhere Oxydationsstufe gebracht wird. Die Vorgänge, die sich bei der Ladung und Entladung abspielen, kann man durch die Gleichung darstellen:
Fe(OH)2 + 2Ni(OH)2 ⇄ Fe + 2Ni(OH)3.
Der Effekt ist also ein solcher, als ob bei der Ladung zwei OH von der negativen zur positiven Elektrode wanderten, und umgekehrt bei der Entladung. Elbs fand auch, daß die elektromotorische Kraft von der Konzentration der Lauge abhängig ist. Nach der obigen Reaktionsgleichung ist die Kalilauge (21%) an[156] dem chemischen Umsatze nicht beteiligt. Förster[117] wies aber nach, daß die Kalilauge nach der Entladung weniger Wasser enthält als am Ende der Ladung. Es scheint demnach, als ob die vorige Gleichung die Vorgänge nicht genau wiedergäbe. (Möglich wäre es allerdings, daß Wasserstoff und Sauerstoff von dem Elektrodenmaterial absorbiert werden.)
J. Zedner hat unter Leitung von Prof. Dolezalek[118] Untersuchungen über den Eisen-Nickel-Akkumulator angestellt. Er fand, daß die positive Elektrode im geladenen Zustande Ni(OH)3, im entladenen Zustande Ni(OH)2.2H2O enthält. Während der Entladung wird also dem Elektrolyten Wasser entzogen. Dem entsprechend müßte die elektromot. Kraft von der Konzentration der Lauge abhängig sein, was auch in der Tat der Fall ist. Die Entladung erfolgt in zwei Stufen; zuerst wird das Nickelhydroxyd in Hydroxydul umgewandelt; die zweite Stufe beruht auf der Verbindung des Sauerstoffs mit Wasserstoff, der während des Ladens von der wirksamen Masse und zwar zumeist von dem ihr beigemischten Graphit eingeschlossen wurde.
Roloff[119] ist der Ansicht, daß außer der von Elbs angegebenen Reaktion noch eine andere stattfindet, wie der stufenweise erfolgende Abfall des Potentials der Eisenelektrode beweise. Das Ni(OH)2, das auf den entladenen Platten ist, hat keine grüne Farbe. Er fand, daß Ni(OH)2 schwarz wird, wenn es Wasser addiert, z. B. ist das Hydrat Ni(OH)2.2H2O schwarz.
Nach der Reaktionsgleichung kommen auf 1 Atom[157] Eisen, das oxydiert wird, 2 Atome Nickel, die an dem Umsatze beteiligt sind; dem entsprechend ist bei Edison die Zahl der Nickelektroden eine doppelt so große wie diejenige der Eisenelektroden.
Da die Kalilauge an dem Umsatze nicht beteiligt ist, so kann der Abstand zwischen den Elektroden sehr klein gemacht werden. Dies ist auch aus dem Grunde von Wert, weil die Anzahl der Platten, um eine bestimmte Kapazität zu erreichen, eine große sein muß. Die Nickel- und Eisenmasse nämlich leiten den Strom sehr schlecht, wahrscheinlich ist auch ihre Porosität wegen des hohen Druckes, dem sie bei der Fabrikation ausgesetzt werden, eine sehr geringe; der chemische Umsatz ist aber, obschon der Elektrolyt nicht an ihm beteiligt ist, nur dort möglich, wo die aktive Masse mit der Lauge in Berührung ist. Die Umwandlungen erfolgen daher nur in einer außerordentlich dünnen Oberflächenschicht. Man muß also eine verhältnismäßig große Anzahl von Platten benutzen, um eine gewünschte Kapazität zu erhalten. Die Ersparnis an Elektrolyt, die man durch das nahe Zusammenrücken der Platten erzielt, wird, wie man leicht einsieht, dadurch wieder z. T. illusorisch, daß man die Anzahl der Platten vergrößern muß.
Konstruktion der Edison-Zelle. Die positive aktive Masse gewinnt Edison dadurch, daß er aus einer Nickelnitratlösung durch Magnesiumhydroxyd das grüne Nickelhydroxydul, Ni(OH)2 fällt; dieses wird durch Chlor zu Nickelhydroxyd Ni2(OH)6 oxydiert. Die negative Masse wird aus Eisenoxyd hergestellt, über dieses wird bei etwa 250° lange Zeit trockener Wasserstoff geleitet, das Fe2O3 wird in Fe3O4 umgewandelt.
Fig. 26.

Die Konstruktion der positiven und negativen Elektroden stimmt, wenigstens bei der H-Type, überein.[158] Das aktive Material, dem Graphit bezw. Quecksilberoxyd (s. oben) zugesetzt wird, wird von kleinen Taschen (77 mm × 13 mm) aufgenommen, die aus dünnem, vernickeltem Eisenblech hergestellt werden[120]. Dieses ist perforiert, damit der Elektrolyt Zutritt hat; auf 1 cm2 kommen fast 300 Löcher. Eine größere Anzahl dieser Taschen wird in ein Gitter aus vernickeltem Stahlblech eingesetzt (s. Fig. 26). Die Platte wird dann sehr stark gepreßt, so daß die Taschen fest und mit gutem Kontakte in dem Rahmen sitzen. In einer zweiten Presse werden die Taschenwände in der Querrichtung gewellt. Die Platten haben oben einen mit einer runden Öffnung versehenen Ansatz. Durch diese wird beim Einbau ein Eisenbolzen geschoben; zwischen je 2 Platten wird eine Eisenscheibe gelegt, um den richtigen Abstand zu erhalten und zu sichern. Platten und Scheiben werden durch Schrauben an den Enden der Bolzen gegeneinander gedrückt. Der Bolzen trägt einen vertikalen Eisenstab, den Polbolzen (s. Fig. 27). Wie schon bemerkt, enthält die Zelle doppelt so viele Nickelelektroden wie Eisenelektroden, die Reihenfolge ist also: Nickel, Eisen, Nickel; Nickel, Eisen, Nickel usw. Zur Isolierung der Platten verschiedenen Potentials gegeneinander dienen Hartgummistäbe.
[159]
Fig. 27.

Der Plattensatz kommt in eine vierkantige Kanne aus vernickeltem Eisenblech, das, um seine Festigkeit zu erhöhen, gewellt ist (s. Fig. 27); er ist gegen den Boden der Kanne durch Hartgummiprismen isoliert und gegen die Seitenwände durch dünne Hartgummiformstücke. Die Zelle wird durch einen Deckel verschlossen, durch den die beiden Polbolzen hindurchgehen, die durch übergeschobene Hartgummibüchsen und Weichgummiringe gegen den Deckel isoliert sind. Der Deckel ist mit einer Füllöffnung und einem Ventil versehen, durch das die bei der Ladung in großer Menge sich bildenden Gase entweichen; es ist so eingerichtet, daß die mitgerissenen Teilchen des Elektrolyten zurückgehalten werden.
Der Elektrolyt soll stets ca. 12 mm über Oberkante der Platten stehen. Den richtigen Stand der Kalilauge konstatiert man mit Hilfe eines Glasrohres mit kleiner Ausflußöffnung, das man wie eine Pipette benutzt. Sinkt der Stand der Flüssigkeit unter das vorgeschriebene Maß, so ist destilliertes Wasser nachzufüllen.
Fig. 28.

Vor einiger Zeit hat Edison die Nickelelektrode wieder anders gestaltet. Die Taschen haben eine runde Form erhalten (s. Fig. 28). Sie sind aus spiralig gewundenem, fein gelochtem Stahlband gefertigt und werden mit Hilfe von Stahlringen außerordentlich verstärkt. Das Nickelhydroxyd[160] wird nicht mehr mit Graphit sondern mit Nickelflocken vermischt, auch soll etwas Wismutoxyd beigemengt werden. Der Kaliumlösung wird eine geringe Menge von Lithium zugesetzt. Die Gasentwickelung soll bei der neuen Type (Type A) geringer[121] und die Leistung bei gleichem Gewichte etwa 25% höher[122] sein als bei der H-Type.
Die Edison-Zelle im Betriebe. Die elektromotorische Kraft der geladenen Zelle beträgt etwa 1,5 Volt. Wird sie mit der normalen Stromdichte, d. h. derjenigen, die der 33⁄4-stündigen Entladung entspricht, beansprucht, so beträgt, wie man aus der Fig. 29 ersieht, die anfängliche Klemmenspannung etwas weniger als 1,4 Volt, gegen Ende der Entladung etwa 1,15 Volt. Im Mittel beläuft sich die Nutzspannung auf 1,23 Volt. Sie ist noch geringer, wenn mit stärkerem Strome entladen wird.
Fig. 29.
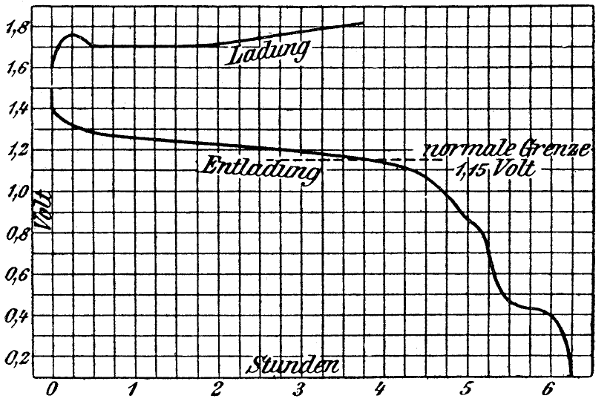
[161]
Die Stromstärke bei der normalen Ladung, die auch rund 33⁄4 Stunde dauert, ist größer als die Entladestromstärke; z. B. wird die Type H27 mit 45 Amp. entladen und mit 65 Amp. geladen. Wie die Klemmenspannung verläuft, ist aus der Fig. 29 zu ersehen. Nach etwa 31⁄3 Stunden hat also die Spannung den Wert 1,8 Volt; man soll dann noch 30-40 Minuten weiter laden. Da die Zelle schon kurz nach Beginn der Ladung gast (daher der niedrige Wirkungsgrad) und die Konzentration des Elektrolyten nur sehr wenig schwankt, so ist es, wenn man ein Voltmeter nicht benutzt, nicht möglich, anzugeben, wann das Ende der Ladung nahe ist. Am besten lädt man dann mit vorgeschriebener Stromstärke und hört nach 33⁄4 Stunden auf; allerdings vergeudet man, wenn die Batterie nicht erschöpft war, unter Umständen viel Energie. —
Vor Beginn der Ladung soll man sich von dem Stande des Elektrolyten überzeugen und ev. nachfüllen. Ein Zusatz von Wasser ist nach jeder zweiten oder dritten Ladung nötig. Die Konzentration der Lauge nimmt langsam ab, da durch die Gase trotz des Ventils kleine Partikelchen des Elektrolyten mitgerissen werden; nach ca. 300 Entladungen soll der Elektrolyt erneuert werden. Die mitgerissenen Laugeteilchen sammeln sich auf dem Deckel und „bilden im Laufe der Zeit einen weißlichen, kristallinischen Niederschlag, der durch gelegentliches Reinigen mit einem Tuch oder Pinsel entfernt wird‟ (Kammerhoff l. c. S. 43).
Wirkungsgrad und Nutzeffekt, die wie beim Bleiakkumulator von der Stromstärke und der zwischen Ladung und Entladung liegenden Zeit abhängig sind, haben ziemlich niedrige Werte; sie werden bei 33⁄4stdg. Ladung und Entladung zu 72% und 52% angegeben. Die Kapazität ist viel weniger von der Entladezeit[162] abhängig als beim Bleiakkumulator. Sie nimmt übrigens im Laufe der Zeit ab; diese Abnahme ist abhängig von der Beanspruchung; nach etwa 600 Entladungen mit stark schwankendem Stromverbrauch, wie er beim Elektromobilbetrieb vorkommt, ist die Kapazität um etwa 15% gesunken.
Vergleich zwischen Blei- und Edison-Akkumulator. Die Endspannung bei dem Edison-Akkumulator sei 1,15 Volt, beim Bleiakkumulator ist sie 1,8 Volt. Für eine 110 Volt-Anlage sind also 110:1,15 = 96 Eisen-Nickel-Zellen, dagegen nur 110:1,8 = 61 Bleiakkumulatoren erforderlich. Weiterhin folgt, daß die Anzahl der mit dem Zellenschalter zu verbindenden Elemente bei Verwendung von Edison-Zellen bedeutend größer ist als bei Benutzung von Bleiakkumulatoren. Was die Überwachnung und Wartung anbelangt, so sind diese, soweit es sich um stationäre Anlagen handelt, für Bleiakkumulatoren einfacher als für Edison-Zellen[123], besonders wenn erstere in Glasgefäße eingebaut sind. Andererseits hat aber die Edison-Zelle manche Vorzüge vor ihrem älteren Rivalen voraus; vor allem ist sie gegen Überanstrengung, sei es daß diese in zu weitgetriebener Entladung, z. B. bis zu 0,5 Volt Spannung, oder in Entnahme anormal starken Stromes besteht, fast ganz unempfindlich; ferner kann die Zelle im entladenen Zustande lange stehen, ohne daß sie Schaden leidet, und daher ist das oft höchst lästige Nachladen, das bei Bleiakkumulatoren erfolgen muß, wenn die Batterie längere Zeit nicht benutzt wird, überflüssig; endlich sind zu erwähnen die große mechanische Festigkeit, verbunden mit der Widerstandsfähigkeit gegen Stöße, und der feste Halt der wirksamen Masse.
[163]
Diese Eigenschaften sind in manchen Fällen so wertvoll, daß man die Mängel gern mit in den Kauf nimmt. Das Hauptgebiet, das sich der Edison-Akkumulator zu erobern gedenkt, ist das Elektromobil. Hier spielen das Gewicht pro Einheit der Leistung und die Raumbeanspruchung eine maßgebende Rolle. Wir wollen zusehen, welcher von den beiden Akkumulatoren in dieser Hinsicht den Vorzug verdient. Dem schon mehrmals erwähnten Buche von Kammerhoff entnehme ich, daß die Type H27, d. h. die H-Type mit 27 normalen Platten, für jedes Kilogramm Totalgewicht 24 Wattstunden leistet[124]; unter Totalgewicht ist das Gewicht der kompletten Zelle inkl. Holzträger zu verstehen. Der Berechnung liegt 33⁄4stündige Entladung zugrunde. In einem Vortrage von Roloff findet man die Angaben, daß man erhält
| bei | einem | stationären Bleiakku | mulator | pro | 1 kg | Gew. | 8 | W-Std. | , | ||
| „ | „ | transportablen[125] | „ | „ | „ | „ | 32 | ,5 | „ | , | |
5stündige Entladung vorausgesetzt. Will man unparteiisch urteilen, so muß man bei dem transportablen Bleiakkumulator auch 33⁄4stünd. Entladung annehmen. Die dieser Zeit entsprechende Kapazität kann zu 5-6% geringer angenommen werden als die bei 5stündiger Entladung; auch ist zu berücksichtigen, daß die mittlere Klemmenspannung etwas kleiner ist. Auf keinen Fall aber bedeutet der Edison-Akkumulator, wenn es sich um transportable Zellen handelt, die in 3-4 Stunden entladen werden sollen, einen Fortschritt hinsichtlich einer Gewichtsverringerung[126].
[164]
Peters[127] gelangt zu der Ansicht, daß der Edison-Akkumulator in keiner Hinsicht mit dem Bleiakkumulator konkurrieren könne. Graefenberg findet, daß der Edison-Akkumulator 16-18 Wattstunden pro 1 kg Gesamtgewicht leiste.
Die Zahlen ändern sich aber zugunsten der Edison-Zelle, wenn es sich um schnelle Entladungen handelt, indem nämlich die Kapazität der Bleizelle in viel höherem Maße von der Entladedauer abhängig ist als diejenige der Edison-Zelle. Auch spricht die Lebensdauer ein wichtiges Wort mit, und diese dürfte bei Bleiakkumulatoren, die 25-30 Wattstunden pro 1 kg Gewicht leisten, keine besonders große sein; wie es in dieser Hinsicht mit den Edison-Zellen bestellt ist, darüber fehlen noch unparteiische Angaben.
Was die Raumbeanspruchung anbelangt, so hat der Bleiakkumulator von vornherein einen Vorsprung, weil er eine viel höhere mittlere Spannung hat als die Edison-Zellen (Verringerung der Zellenzahl). Kammerhoff berechnet, daß die Type H27 bedarf
| bei | 33⁄4 | stdg. | Entladung | pro | 1 | Kilowattstd. | 31,17 l, |
| „ | 11⁄4 | „ | „ | „ | 1 | „ | 35,07 l; |
angenommen ist, daß je 6 Zellen in einen Holzkasten eingebaut sind. Für eine Bleizelle, die für Elektromobilbetrieb bestimmt ist, wird angegeben, daß ohne Holzkasten erforderlich sind
| bei | 5 | stdg. | Entladung | pro | 1 | Kilowattstd. | 13,08 | l, |
| „ | 1 | „ | „ | „ | 1 | „ | 25,46 | l. |
Nach Roloff sind für transportable Bleizellen 12 l pro Kilowattstunde und für die Edison-Zelle 19 l erforderlich. Auch hier fragt es sich, ob die Raumverringerung nicht auf Kosten der Lebensdauer erkauft ist.
[165]
Die Angaben, die man über die Lebensdauer der für Elektromobilbetrieb bestimmten Batterien findet, widersprechen sich. Während Joly in dem (a. S. 160) zitierten Aufsatze behauptet, daß der Bleiakkumulator 3000-3500 Meilen leiste, die Edison-Zelle aber nur 2500 Meilen, berechnet Kammerhoff (l. c. S. 152), daß die Lebensdauer des Bleiakkumulators im günstigsten Falle 9750 Wagenkilometern und diejenige einer um etwa 30% leistungsfähigeren Edison-Batterie 54000 Wagenkilometern entspreche. Natürlich sind auch die Preise für die Batterien in Rechnung zu setzen. Übernimmt die Fabrik gegen Zahlung einer gewissen Summe, sei es pro Jahr oder sei es pro Wagenkilometer, die volle Unterhaltung (inkl. Erneuerung der Platten), so spielt die Lebensdauer für den Besitzer des Wagens keine Rolle, und es treten dann die früher erörterten Faktoren um so mehr in den Vordergrund.
Ein definitives Urteil über den Wert des Eisen-Nickel-Akkumulators kann noch nicht gefällt werden; man muß berücksichtigen, daß er erst einige Jahre alt ist, während der Bleiakkumulator auf eine etwa 25jährige Vergangenheit zurückblicken kann, während deren an seiner Vervollkommnung Tausende von Theoretikern und Praktikern gearbeitet haben. Einstweilen kann der Edison-Akkumulator nur in einigen beschränkten Anwendungsgebieten mit dem Bleiakkumulator erfolgreich konkurrieren.
Der Zink-Nickel-Sammler ist einstweilen nur von theoretischem Interesse und soll nur der Vollständigkeit halber erwähnt werden. Analog wie die Nickelplatten des Edison-Akkumulators lassen sich Masseplatten aus Zink herstellen. Der Masse wird Graphit und Pottasche zugesetzt, ersterer verhindert, daß der bei der Ladung sich bildende Zinkschwamm zusammensintert, die Pottasche löst sich, und es bilden sich Hohlräume, die beim Quellen der Masse Platz gewähren.
[113] E. T. Z. 1905 S. 301.
[114] Letzteres ist für zweiwertiges Blei 103,2, für zweiwertiges Nickel nur 29,3.
[115] S.: A. Kammerhoff. Der Edisonakkumulator. Berlin, 1910.
[116] E. T. Z. 1905, S. 756.
[117] Zeitschr. für Elektrochemie 1908, Nr. 21.
[118] Zeitschr. für Elektrochemie 1906, S. 463 oder E. T. Z. 1906, S. 999.
[119] E. T. Z. 1905, S. 756.
[120] Aus der aktiven Masse werden kleine Briketts von etwa 1 mm Dicke hergestellt.
[121] Siehe Elektrische Kraftbetriebe und Bahnen, 1910, Nr. 23 (Kammerhoff) oder E. T. Z. 1910, S. 404.
[122] Siehe The Electrical Times, 1910 (17. Nov.).
[123] Man vergleiche die Vorschriften über Ladung, Entladung usw.
[124] Für die neueste Type werden 30 Wattstunden pro 1 kg Totalgewicht angegeben. Siehe E. T. Z. 1910, S. 404.
[125] Ohne Holzkasten oder dgl.
[126] Über die neueste Type (s. S. 159) liegt noch zu wenig Beobachtungsmaterial vor.
[127] E. T. Z. 1908, S. 1232.
[128] Zentralblatt für Akkum. u. Galvanotechnik 1908, S. 49.
[166]
Die Verwendung der Akkumulatoren ist eine so vielseitige, daß es ganz ausgeschlossen ist, sie in diesem kleinen Werkchen auch nur einigermaßen erschöpfend zu behandeln.
1. Am wichtigsten ist die Verwendung der Akkumulatoren in elektrischen Anlagen. Wir beschränken uns hier auf den einfachsten Fall, nämlich auf die Zweileiteranlage, bei der die Batterie parallel zur Dynamo geschaltet wird. Machen wir uns zunächst klar, welchen Nutzen die Verwendung der Akkumulatoren gewährt. Eine Lampe brennt nur dann ruhig, wenn die Potentialdifferenz zwischen den Zuleitungsdrähten konstant ist. Bei reinem Maschinenbetrieb ist es aber ganz unmöglich, in einer Anlage mit stark schwankendem Konsum die Klemmenspannung der Dynamo konstant zu halten[129]. Ist nun eine Akkumulatorenbatterie parallel zur Dynamo geschaltet, so werden durch sie die Schwankungen ausgeglichen, so daß die Lampen ein gleichmäßiges Licht ausstrahlen. Ja, man kann, wenn man Akkumulatoren zu Hilfe nimmt, Kraftmaschinen benutzen, die an und für sich nicht sehr[167] regelmäßig laufen, z. B. Wasserräder. Sodann ermöglichen die Akkumulatoren eine ökonomische Ausnutzung der Maschinen. Bekanntlich nämlich arbeiten Dampfmaschinen und Dynamos mit dem günstigsten Wirkungsgrade, wenn sie voll belastet sind. Ist nun der Konsum gering, so kann die Dynamo Strom an die Batterie abgeben; wird die Netzbelastung so groß, daß eine Dynamo zu stark belastet sein würde und zwei zu schwach, so gibt die Batterie so lange Strom ab, bis es sich lohnt, die zweite Dynamo in Betrieb zu setzen. In den frühen Morgen- und späten Abendstunden ist die Energieabgabe der Zentrale meistens so gering, daß eine Dynamomaschine verhältnismäßig schwach belastet sein würde. Man überträgt dann der Batterie die Stromlieferung. Hierdurch wird nicht nur eine nicht unbedeutende Ersparnis an Betriebsmaterial, sondern auch eine einfachere und billigere Bedienung ermöglicht.
Bei kleineren Anlagen können die Akkumulatoren im Sommer die Speisung der Lampen usw. eventuell ganz übernehmen.
Die stete Bereitschaft der Akkumulatoren kann endlich unter Umständen von großem Nutzen sein (Reparaturen an Maschinen usw.). Durch die Batterie wird also die Betriebssicherheit bedeutend erhöht, sie bildet die letzte, aber durchaus zuverlässige Reserve.
Der Umstand, daß sich die Spannung des Akkumulators sowohl während der Entladung als auch besonders während der Ladung ändert, bedingt die Anwendung eines besonderen Apparates, des Zellenschalters. Da während der Entladung die Klemmenspannung der Elemente langsam sinkt[130], so muß man,[168] wenn die Spannung in der Zentrale möglichst auf konstanter Höhe gehalten werden soll, von Zeit zu Zeit eine der in der Reserve stehenden Zellen zu den bereits an der Stromlieferung beteiligten hinzuschalten. Bei 110 Volt z. B. genügen bei Beginn der Entladung etwa 55 Elemente, ist die Spannung jeder Zelle bis zu 1,97 Volt gesunken, so fehlen ca. 1,8 Volt, so daß die Zelle Nr. 56 hinzugeschaltet werden muß. Da man bis zu etwa 1,8 Volt entlädt, so sind 61 Zellen erforderlich[131], von denen die 6 letzten als Schaltzellen dienen. Diese werden natürlich nicht so stark beansprucht wie die Elemente 1 bis 55. Wird nun geladen, so fangen die Schaltzellen früher an zu gasen und müssen abgeschaltet werden.
Fig. 30.
Derjenige Apparat, der es ermöglicht, nach Bedarf Zellen ab- oder hinzuzuschalten, ist der Zellenschalter. Das Prinzip desselben soll an der Hand der Fig. 30 erläutert werden. Die 6 letzten Zellen der Batterie sind mit I, II bis VI bezeichnet und durch Drähte mit den Kontaktstücken c1 bis c6 des Zellenschalters verbunden. Diese und ebenso der drehbare Schleifkontakt[169] H sind auf einer gut isolierenden Unterlage montiert. Die Nutzleitung ist mit dem positiven Pole der letzten Zelle und mit dem Hebel verbunden. Befindet sich H in der Lage 1, so fließt der Strom durch die Nutzleitung, die Lampen L, nach a, über c2 zum negativen Pole der Schaltzelle II. Die mit III bis VI bezeichneten Elemente sind also an der Stromlieferung nicht beteiligt. Dreht man H in die Lage 2, so sind alle Zellen eingeschaltet.
Soll der Strom während des Hinzu- oder Abschaltens einer Zelle nicht unterbrochen werden, so muß der Hebel H den folgenden Kontakt schon berühren, bevor er den vorhergehenden verläßt.
Liegt nun H beispielsweise zugleich auf c2 und c3, so ist die Zelle III kurz geschlossen; denn ihr positiver Pol ist durch die nach c2 und c3 gehenden Verbindungsdrähte, durch den Hebel und die beiden erwähnten Kontaktstücke mit dem negativen Pole verbunden. Durch den Kurzschluß kann die Zelle Schaden leiden. Um den Übelstand zu beseitigen, schaltet man zwischen die Kontaktstücke c1, c2 usw. kleinere Kontaktstücke a, b, c usw., die sogenannten Zwischenkontakte, und verbindet, wie es aus der Fig. 31 zu ersehen ist, die Zwischen- und die Hauptkontakte durch Widerstände w. Natürlich darf jetzt der Schleifkontakt nicht so breit sein, daß er zwei Hauptkontakte, z. B. c1 und c2, gleichzeitig berührt.
Fig. 31.
Bei der durch unsere Figur angedeuteten Anordnung muß für jede Schaltzelle ein besonderer Zwischenwiderstand[170] vorgesehen werden. Man kommt aber mit einem Zwischenwiderstand aus, wenn man den Schleifkontakt H (Fig. 30) der Länge nach halbiert und die gegeneinander isolierten Hälften durch einen Widerstand (eine Drahtspirale) miteinander verbindet. Die Zwischenkontakte a, b, c usw. der Fig. 31 können bei dieser jetzt meistens benutzten Anordnung in Wegfall kommen. Um aber eine ganz ebene Schleiffläche für die Kontaktbürste zu erzielen, legt man zwischen die Kontaktstücke Scheiben aus Glas oder Schiefer.
Fig. 32.
Ein solcher Einfachzellenschalter ist in Fig. 32 abgebildet.
Schaltung. In Fig. 33 ist die Parallelschaltung mit Einfachzellenschalter schematisch dargestellt. Die Batterie kann nicht gleichzeitig Strom aufnehmen und abgeben. Während der Ladung hat die Maschine D eine höhere Spannung als die normale, die wir zu 110 Volt annehmen wollen. Dem Zellenschalterhebel h gibt man eine solche Lage, daß die Spannung der zwischen ihm und dem Punkte e liegenden Zellen 110 Volt beträgt, die Lampen L also mit normaler Spannung brennen. Der von der Maschine kommende Strom teilt sich an dem Schleifkontakte h des Zellenschalters; durch die Zellen, die rechts von dem Schalthebel (zwischen h und d) liegen, fließt also der ganze Maschinenstrom, durch die anderen Elemente die Differenz zwischen diesem Strome und dem durch die Lampen gehenden. Die zuerst erwähnten Zellen sind also früher geladen (auch aus dem Grunde, weil sie bei der Entladung[171] weniger stark beansprucht wurden). Da sie aber nicht abgeschaltet werden können, so müssen sie so lange Strom aufnehmen, bis die übrigen Zellen vollgeladen sind. Dies hat zwei Nachteile; erstens ist hierdurch ein nicht unbedeutender Arbeitsverlust bedingt,[172] zweitens ist das jedesmalige Überladen den Elementen schädlich. Daher ist der Betrieb mit Doppelzellenschalter vorzuziehen.
Fig. 33.
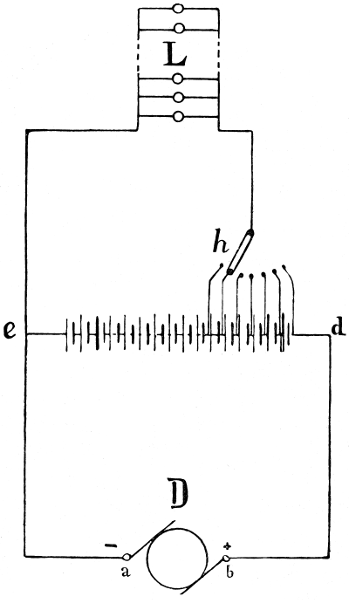
Die Anzahl der Schaltzellen ist bei der Schaltung nach Fig. 33 eine große. Sind z. B. bei 110 Volt 61 Zellen vorhanden, und rechnen wir als Endspannung einer Zelle bei der Ladung 2,75 Volt, so dürfen gegen Ende der Ladung nur 110:2,75 = 40 Elemente mit dem Netze verbunden sein; es müssen also 21 Zellen abschaltbar sein.
Die Schaltung bei Verwendung eines Doppelzellenschalters ist in Fig. 34 dargestellt[132]. Der Betrieb gestaltet sich folgendermaßen:
a) Die Batterie und die Dynamo D geben Strom ab (Parallelbetrieb). Der Hebel v des Umschalters liegt auf dem Kontakte 2, hat also die in der Figur angedeutete Lage; der Entladehebel c1 des Doppelzellenschalters wird so lange gedreht, bis die Spannung der zwischen B und c1 liegenden Zellen gleich ist der Klemmenspannung der Maschine. Diese wird gemessen, wenn man den Hebel des Voltmeterumschalters auf den mit 3 bezeichneten oder auf den zur Leitung 4 (oder 5) zugehörigen Kontakt legt[133]. Ob die Batterie Strom abgibt oder aufnimmt, erkennt man an dem Stromrichtungszeiger R, der aus einer durch den Strom abgelenkten Magnetnadel besteht.
[173]
Fig. 34.
D = Dynamo, E = Automatischer Schwachstromschalter, B = Bleisicherung, A1, A2 = Ampermeter, V = Voltmeter, R = Stromrichtungsanzeiger.
b) Ladung. v liegt auf 1; die Meßleitung 5 steht also jetzt mit dem Ladehebel in Verbindung. Ehe die Maschine auf die Batterie geschaltet wird, muß sie bis[174] zu einer Spannung erregt werden, die etwas höher ist als die Spannung der Batterie (siehe auch S. 94). Die Maschinenspannung bei geöffnetem Stromkreise (der Schwachstromautomat E ist noch nicht eingeschaltet) wird gemessen, wenn man den Hebel des Voltmeterumschalters auf den Kontakt der Leitung 4 legt; die Batteriespannung erhält man, wenn man c auf das Kontaktstück der letzten Zelle dreht und das Voltmeter mit der Leitung 5 verbindet. Der Maschinenstrom fließt durch die zwischen c und c1 liegenden Zellen und teilt sich bei c1, indem ein Teil durch den Entladehebel nach den Lampen L, ein Teil durch die links von c1 liegenden Zellen geht. Natürlich muß c1 so gedreht werden, daß die Spannung der zuletzt erwähnten Elemente 110 Volt beträgt.
Feststellung der richtigen Type. Es ist von Wichtigkeit, daß man bei einer solchen Anlage die richtige Akkumulatorentype wählt. Um diese zu erhalten, bestimmt man die verlangte Leistung in Amp.-Stdn. — sie sei Q — und die höchste vorkommende Entladestromstärke. Der Akkumulator muß so bemessen werden, daß er mit dem Strome J beansprucht werden darf und seine Kapazität auch bei Entladung mit dem Strome J mindestens gleich Q ist[134]. Natürlich wählt man im Zweifel lieber eine zu große Type.
Pufferbatterien. Batterien, die den Zweck haben, die Stöße, die durch starke und schnell wechselnde Belastungsschwankungen auf die Maschinen ausgeübt werden, von den letzteren fernzuhalten, nennt man Pufferbatterien. Ihre Verwendung gewährt also den Vorteil, daß die Belastung der Dynamo eine gleichmäßigere und daher ihre Lebensdauer und ihr Wirkungsgrad[175] höher sind; ferner wird die Betriebssicherheit erhöht. Von Wichtigkeit ist auch, daß, wenn eine Pufferbatterie projektiert wird, die Maschinenanlage nicht dem nur für kurze Zeit vorhandenen maximalen Strome, sondern dem mittleren Konsume zu entsprechen braucht. Besonders bei elektrischen Bahnanlagen finden solche Batterien ausgedehnte Verwendung. Hier — zumal bei kleiner Anzahl der Wagen — können größere Belastungsänderungen durch das Halten und Anfahren der Wagen und durch stärkere Steigungen verursacht werden. Die Pufferbatterie soll, wenn die Klemmenspannung der Dynamo, mit der sie parallel geschaltet ist, bei stärkerer Zunahme der Netzstromstärke J abzufallen beginnt (Ankerrückwirkung), Strom in die Leitung schicken und Strom aufnehmen, wenn J unter den normalen Betrag sinkt. Könnte die Batterie ihre Aufgabe in vollkommener Weise erfüllen, so würden Dynamo und Dampfmaschine stets gleichmäßig belastet sein und mit dem günstigsten Wirkungsgrade arbeiten.
Soll die Batterie nur die Belastungsschwankungen ausgleichen, so gibt sie im Laufe eines Tages ungefähr so viel Strom ab, wie ihr zugeführt wird; wählt man die Batterie so groß, daß sie im Notfalle eine oder mehrere Maschinengruppen vertreten kann, oder regelmäßig bei schwachem Konsume den Strombedarf deckt, so wird sie zur Kapazitätsbatterie.
Das Verhalten einer Pufferbatterie während des Betriebes erfordert ein eingehendes Studium, da eine ganze Reihe von Momenten zu berücksichtigen ist; hier können nur einige Andeutungen Platz finden. Daß die Dynamo mit konstantem Strome arbeitet, ist ganz ausgeschlossen. Denn wenn das der Fall wäre, so wäre ihre Klemmenspannung ebenfalls konstant, und dann könnte die Batterie weder Strom aufnehmen noch Strom[176] abgeben. Die Spannung der Dynamo muß sich also mit der Belastung ändern. Wenn z. B. der Verbrauchsstrom wächst, so muß zunächst die Klemmenspannung der Dynamo abfallen, diese aber sinkt erst dann, wenn die Maschine einen stärkeren Strom abgibt[135].
Die Pufferwirkung ist, was die Batterie anbelangt, abhängig von dem Spannungsabfall bei Stromabgabe und von dem Spannungsanstieg bei Stromzufuhr, und zwar nicht nur dem dem inneren Widerstande entsprechenden, sondern vor allem dem durch die Änderung der elektromotorischen Kraft verursachten. Dieser letztere Teil hängt von der Stromdichte und der Geschwindigkeit ab, mit der sich die Konzentration der Säure in den Poren der wirksamen Masse ändert, also von der Plattenkonstruktion und von der Porosität der aktiven Masse. Auch die Dauer der Entladung und der Ladezustand der Zellen spielen eine Rolle. Eine Zelle, die fast bis zur Gasentwicklung geladen ist, verhält sich, wenn man zur Entladung übergeht, anders wie eine Zelle, die nahezu erschöpft ist[136]. Bei größerer Stromaufnahme steigt die Klemmenspannung eines Akkumulators schnell, mag das Element fast entladen oder nahezu voll geladen sein (man vergleiche die Kurve Fig. 35 mit derjenigen in Fig. 7 a. S. 81).
Fig. 35.
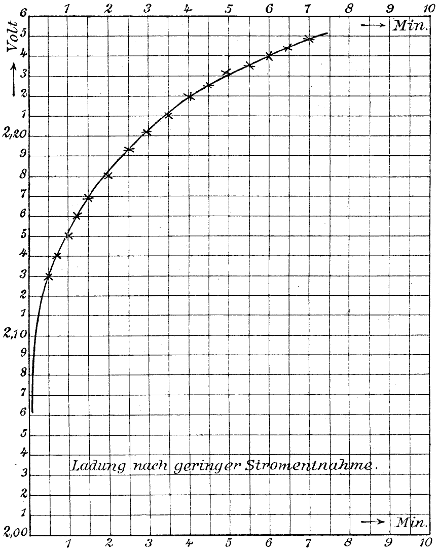
Am ungünstigsten dürften die Verhältnisse liegen, wenn sich an eine Periode schwachen Konsums, in der die Batterie Strom aufnimmt, sofort eine Periode stärkeren Stromverbrauchs, verbunden mit Stromabgabe seitens der Batterie, anschließt; denn es wird dann in ganz kurzer Zeit auch bei geringer Stromabgabe die Zellenspannung stark abfallen.
[177]
Soll die Batterie dauernd ihre Kapazität behalten, so muß sie in jeder Woche (nach den Vorschriften der Akkum. Fabr. Akt.-Ges.) zweimal mindestens mit ihrer halben Kapazität beansprucht werden, außerdem muß sie täglich bis zu 2,75 Volt pro Zelle geladen werden. Sieht man von dieser umständlichen Behandlung ab, so erfolgt geringe Sulfatierung, die Batterie wird dann in irgend einem Bedarfsfalle nicht die volle Kapazität abzugeben in der Lage sein, jedoch immer noch allen praktischen Anforderungen gerecht werden.
Die Entladung darf mit der der einstündigen Beanspruchung entsprechenden Stromstärke geschehen.[178] Die Kapazitäts-Batterie soll möglichst oft zur Arbeitsleistung herangezogen werden und täglich morgens vor Beginn des Maschinenbetriebes und abends nach Stillsetzen der Maschinen zur Stromabgabe benutzt werden.
Um die Pufferwirkung, die an und für sich wegen der schnellen Änderungen der elektromotorischen Kraft nicht in befriedigender Weise erfolgt, zu erhöhen, hat man besondere Schaltungen ersonnen. Eine häufig angewandte Anordnung besteht in der Verwendung der Piranischen Pufferzusatzmaschine. Diese wird durch einen Elektromotor angetrieben und hat 2 Magnetwicklungen. Die eine, mit hohem Widerstande, ist mit den Polen der Akkumulatorenbatterie verbunden, die zweite, von geringem Widerstand, ist einem vom Netzstrome durchflossenen Widerstande parallel geschaltet. Die beiden Ströme wirken im entgegengesetzten Sinne magnetisierend. Der normale Netzstrom sei J und der augenblickliche J1. Ist J = J1, so heben sich die beiden Erregerströme auf, die Zusatzmaschine entwickelt keine Spannung, und der Akkumulator gibt keinen Strom ab. Ist J1>J, so hat die Maschine eine Spannung, die sich zu derjenigen der Batterie addiert, so daß sie Strom abgibt, etc.
Auch bei Drehstrom gelangen Akkumulatorenbatterien zum Puffern zuweilen zur Anwendung[137]. Man kann an das Netz einen Motorgenerator, d. h. einen Drehstrommotor, der eine Gleichstrommaschine antreibt, oder einen Drehstrom-Gleichstrom-Umformer anschließen. Die Gleichstromseite ist mit einer Batterie parallel geschaltet. Wenn nun in der Zentrale die Umdrehungszahl der Drehstromdynamo sinkt, so sinkt auch diejenige des Motors bezw. Umformers, die Gleichstrommaschine[179] hat niedrige Spannung und die Batterie gibt Strom ab. Der Umformer wird durch Gleichstrom angetrieben und wirkt als Drehstromgenerator, d. h. er gibt Strom an das Netz ab. Umgekehrt nimmt die Batterie Strom auf, wenn sich die Umdrehungszahl der Motordynamo erhöht. Die Anordnung ist besonders dann am Platze, wenn der Kraftbedarf sehr stark schwankt, wie es z. B. bei Fördermaschinen in Bergwerken der Fall ist.
Umwandlung der Spannung. Bei großen elektrischen Anlagen benutzt man zuweilen auch Akkumulatorenbatterien, um die hohe Netzspannung in niedrigere Gebrauchsspannung umzuwandeln. Nehmen wir z. B. an, daß man Bahnstrom von 600 Volt einer an der Bahnstrecke gelegenen Gemeinde für die Speisung von Lampen von 110 Volt zuführen will. Man kann dann an dem betreffenden Orte etwa 220 Zellen, die in Reihe geschaltet sind, durch den Bahnstrom direkt oder durch eine Motordynamo laden, die durch den Bahnstrom angetrieben wird. Bei der Entladung bildet man aus der großen Batterie Gruppen, die parallel geschaltet werden.
Akkumulatorenwagen für Bahnbetrieb. In den letzten Jahren sind wieder vielfach Versuche mit Akkumulatoren-Triebwagen gemacht worden. Diese sollen dem Zwecke dienen, auf Haupt- und Nebenbahnen, wo ein genügendes Bedürfnis vorhanden ist, einen Zwischenverkehr neben den großen durchgehenden Hauptzügen zu ermöglichen (Vorortverkehr, Anschluß an Stationen, wo Schnellzüge halten usw.). Nach dem Entwurf des Geheimen Baurats Wittfeld sind für die preußischen Staatsbahnen Akkumulatoren-Doppelwagen[138] ausgeführt worden. Ein solcher besteht aus zwei kurzgekuppelten zweiachsigen Einzelwagen, von denen jeder[180] in einem Vorbau mit einer Achse eine Akkumulatorenbatterie enthält. Diese besteht aus 168 Zellen mit 368 Amp.-Stdn. Kapazität. Die Wagen können ca. 100 km mit voller Belastung zurücklegen. Lötverbindungen sind vermieden, so daß man die einzelnen Teile (Hartgummikästen) leicht herausnehmen kann (Akk.-Fabrik, Akt.-Ges.). Auf pfälzischen Bahnen sind seit längerer Zeit mit Akkumulatorenwagen so günstige Erfahrungen gemacht worden, daß eine größere Anzahl von Wagen in Auftrag gegeben wurde.
Elektromobile. An die Batterien für Elektromobile werden besondere Anforderungen gestellt: Möglichst geringes Gewicht pro Einheit der Leistung, ohne daß die Lebensdauer zu sehr herabgesetzt wird (siehe S. 164), große Widerstandsfähigkeit gegen mechanische Erschütterungen, die während der Fahrt oft recht stark sein können, Unempfindlichkeit gegen Überlastungen (Anfahren etc.), möglichst geringe Raumbeanspruchung. Für jede Tonne Gewicht, das zu bewegen ist, ist eine gewisse Zugkraft nötig (13-30 kg), die man als Traktionskoeffizient bezeichnet. Dieser hängt von verschiedenen Umständen ab: von der Bereifung (Vollgummi, Pneumatik, Eisen), von dem Totalgewichte selbst, vor allem von der Beschaffenheit und dem Zustande der Straßen. Ein Personen-Elektromobil erfordert etwa 3 PS. bei 20 km Geschwindigkeit einschl. Energie-Verlust im Motor und Kontroller, der durchschnittlich etwa 25% beträgt. Da schon geringe Steigungen recht hohe Anforderungen an die Batterie stellen, so sind in bergischen Gegenden Elektromobile nicht am Platze. Sie kommen einstweilen nur für Städte in Frage. (Näheres siehe Kammerhoff l. c. S. 116, ferner seien hervorgehoben die Arbeiten von E. Sieg in der E. T. Z. 1905, S. 311 und in E. T. Z. 1906, S. 1017.)
[181]
Sieg weist nach, daß der Akkumulator für Elektromobile pro 1 kg Gewicht mindestens 30 Wattstunden leisten muß, wenn er bei den üblichen Geschwindigkeiten von 25-30 km in der Stunde die geringsten Betriebskosten fordern soll. Die Platten werden in der früher beschriebenen Weise durch gewellte Hartgummischeiben oder Holzbrettchen gegeneinander isoliert. Die übliche Zellenzahl ist 40-44, entsprechend 110 Volt Endspannung bei der Ladung. Die Akkumulatoren werden in Holzkästen untergebracht. Der Antrieb erfolgt am besten durch die Vorderräder; die Motoren werden entweder unmittelbar mit dem Rade gekuppelt oder in dieses eingebaut, oder man kann den Motor durch Zahnradübersetzung auf die Räder wirken lassen.
Auch bei Automobilen mit Benzinmotoren finden Akkumulatoren Anwendung und zwar für die Beleuchtung, die elektrische Huppe, als Zünderzellen etc.
Im Telegraphenbetrieb sind die Akkumulatoren besonders dann den Primärelementen überlegen, wenn es sich um den Betrieb langer Kabelleitungen handelt. Bei diesen spielt die elektrostatische Kapazität eine wichtige Rolle. Bei jedem Zeichen nämlich, das telegraphiert wird, d. h. bei jedem Stromschluß, muß das Kabel zunächst durch die Stromquelle geladen werden; die Ladung verläuft aber umso schneller, je kleiner der innere Widerstand der Batterie ist. Durch Verwendung von Akkumulatoren wird somit die Telegraphiergeschwindigkeit vergrößert. Bei vielen Ämtern werden seit Jahren Sammler von 14 Amp.-Stdn. Kapazität verwendet, die entweder aus Kupferelementen oder aus dem Netz des Elektrizitätswerkes geladen werden.
Im Telephonbetrieb haben sich Akkumulatoren als Stromquellen für die Vermittlungsämter und bei dem Vielfachsystem mit Zentralbatteriebetrieb[139] gut bewährt. Dagegen scheinen ausgedehnte Probeversuche,[182] den Akkumulator als Stromquelle für die Mikrophone bei den einzelnen Sprechstellen zu verwenden, nicht zu einem befriedigenden Resultate geführt zu haben, indem die wegen des Mangels einer — kaum durchzuführenden — genügenden Überwachung der einzelnen Elemente häufig vorkommende Sulfatierung der Platten und die damit verbundene Schwierigkeit der Ladung große Unterhaltungskosten verursachen[140].
Am besten dürften sich für Telephonbetrieb Akkumulatoren mit Masseplatten bezw. Faureplatten eignen, da bei diesen die Selbstentladung während der Ruhepausen geringer ist als bei Großoberflächenplatten und daher auch die Gefahr, daß Sulfatierung erfolgt (s. S. 111).
Sogenannte Kleinakkumulatoren finden zahlreiche Verwendungen, von denen noch folgende hervorgehoben seien: Beleuchtung von Lampen in Wagen, tragbare Lampen (Taschenlampen, Handlampen), Beleuchtung von Treppen, Antrieb von kleinen Ventilatoren usw.
Verwendung der Akkumulatoren im Laboratorium (Lehrzwecke, therapeutische Zwecke etc.). Bei sachgemäßer Behandlung bilden die Akkumulatoren eine Stromquelle, die allen Anforderungen in bester Weise genügt; sie sind stets betriebsbereit, die Bedienung und Kosten sind im Vergleich zu Primärelementen außerordentlich gering, man kann längere Zeit nahezu konstanten und starken Strom entnehmen. Versagt ein Akkumulator frühzeitig, so ist der Grund fast immer in Fehlern zu suchen, die bei der Behandlung gemacht worden sind; vor allem wird oft gegen die Vorschriften gesündigt, daß eine gewisse Stromstärke bei der Entladung nicht überschritten werden darf, daß die Entladung nur bis zu einem gewissen Punkte getrieben[183] werden darf und daß zwischen Entladung und Ladung nur eine kurze Zeit liegen soll.
Am besten werden Glaszellen verwendet, damit man das Innere besichtigen kann. Werden die Elemente bald hier, bald dort verwendet, so stellt man sie in mit Griffen oder Tragriemen versehene Holzkästen, deren Höhe etwa 2⁄3 der Höhe der Zelle beträgt, oder bei denen die Vorder- und Hinterwand zum Teil herausgenommen sind, wie es die Fig. 36 zeigt.
Fig. 36.
Damit man die Spannung leicht ändern kann, befestigt man an einer Seite des Kastens ein Schaltbrettchen, dessen Kontaktstücke mit den Polen der einzelnen Zellen verbunden sind. Durch Stöpsel, die man in die zwischen den Kontaktstücken befindlichen Löcher schiebt, kann man die Schaltungen vornehmen, z. B. kann man bei 4 Zellen auf 2, 4 und 8 Volt schalten. Zu beachten ist, daß man nicht durch falsche Stöpselung Kurzschluß herstellt. Bequemer ist die Verwendung eines Pachytrops, einer Einrichtung, bei der die verschiedenen Schaltungen durch Drehen einer Walze oder eines Rades vorgenommen werden; die Herstellung von Kurzschluß ist ausgeschlossen. In Fig. 37 ist eine Batterie aus 12 Elementen, wie sie von Kohl in Chemnitz in den Handel gebracht wird, abgebildet. Die auf der Pachytropwalze schleifenden federnden Kontaktstreifen sind mit den Polen der Elemente durch Drähte verbunden, die durch Klemmen festgehalten[184] werden, so daß man jedes einzelne Element zwecks Besichtigung leicht aus dem Kasten heben kann.
Fig. 37.

Für kleine Batterien, die nur selten ganz entladen werden, sind Faure-Platten (als positive und negative) den Großoberflächenplatten vorzuziehen, da bei ersteren die Selbstentladung und daher auch die Gefahr, daß Sulfatierung eintritt, geringer ist als bei letzteren. Zu beachten ist auch, daß die Zellen zuweilen ganz entladen werden müssen (s. Kap. 7). Werden die Akkumulatoren oft transportiert, so fällt leicht aktive Masse heraus, durch die ein Kurzschluß bewirkt werden kann. Es empfiehlt sich daher, bei solchen Zellen den Plattenabstand reichlich groß zu wählen.
Für viele Untersuchungen, z. B. über die Bewegung der Elektrizität durch Gase, sind Hochspannungsbatterien[185] die besten Stromquellen, weil sie bei der geringen erforderlichen Stromstärke den Elektroden der Röhre lange Zeit konstante Spannung zuführen. Größere Verbreitung hat die Hochspannungsbatterie nach Feußner[141] gefunden. In einem auf Rollen laufenden starken Eichenschrank befinden sich 500 kleine Elemente mit je einer positiven und einer negativen Elektrode. Als Glasgefäß dienen Pulverflaschen. Damit keine Säure herauskriechen und Nebenschlüsse herstellen kann, werden die Gläser mit einer Harzschicht luftdicht zugegossen; für die bei der Ladung auftretenden Gase wird ein besonderer Austrittsweg (Glasröhrchen) vorgesehen. Die die einzelnen Gruppen (25 Elemente) tragenden Bretter ruhen auf 4 Porzellanglocken. Zwei Schaltleisten aus Hartgummi mit Hartgummigriffen gestatten mit einem Handgriff Parallelschaltung der Batterie zur Ladung mit 125 Volt oder Hintereinanderschaltung auf 1000 Volt vorzunehmen. Die Kapazität beträgt ca. 1 Amperstunde bei 0,1 Amp. Entladestrom.
Am Schlusse dieses Kapitels sei noch hervorgehoben, daß der Bleiakkumulator selbst ein interessantes Versuchsobjekt ist. Es seien folgende Versuche und Arbeiten erwähnt: Änderung der elektromot. Kraft am Anfang und gegen Ende der Ladung und Entladung, Bestimmung der Kapazität, Abhängigkeit der Kapazität von der Säuredichte, Ermittelung des Wirkungsgrades und des Nutzeffektes, Änderung der elektromot. Kraft mit der Säuredichte und der Temperatur (s. S. 42). Bei verschiedenen dieser Arbeiten muß eine genaue Messung[186] der elektrom. Kraft vorgenommen werden. Dieser wichtigen Aufgabe sollen noch einige Worte gewidmet werden. In den meisten Fällen erhält man die gesuchte Größe mit hinreichender Genauigkeit, wenn man die Klemmen des nicht belasteten Akkumulators mit einem empfindlichen Voltmeter für kleine Spannungen verbindet. Da aber solche Voltmeter einen Strom von 120-110 Amp. verbrauchen, so macht sich bei kleinen Zellen schon die Konzentrationspolarisation bemerkbar. Am einwandfreiesten ist die Kompensationsmethode nach Poggendorff, bei der die elektromot. Kraft bestimmt wird, ohne daß die Zelle Strom abgibt. Das Prinzip dieser Methode ist folgendes: Es sei B in Fig. 38 eine Batterie von 2 kleinen Akkumulatoren, W ein Widerstand von 4000 Ohm, a c ein Widerstand von 6000 Ohm, X ein Normalelement, dessen elektromotorische Kraft En man genau kennt. Die Batterie gibt, wenn die Gleichgewichtsbedingung erfüllt ist, d. h. wenn durch den Nebenkreis a X G d kein Strom fließt, einen Strom von E10000 Amp. ab, wo E ihre elektrom. Kraft ist. Mithin beläuft sich der Spannungsverlust in a c auf 6000 . E10000 = 0,6 . E Volt (angenähert auf 2,4 Volt). Da auf jeden Fall die elektrom. Kraft des Normalelementes kleiner ist als 0,6 . E, so gibt es zwischen a und c einen Punkt d, so daß der dem Batteriestrom[187] entsprechende Spannungsabfall von a bis d gleich En ist. Hat man diesen Punkt gefunden, so fließt durch das Galvanoskop G kein Strom. Der Widerstand zwischen a und d betrage Wn Ohm, dann ist En = Wn . E10000 Volt.
Fig. 38.
Jetzt wird das Normalelement durch den Akkumulator ersetzt, dessen elektrom. Kraft man messen will, und man sucht wieder einen Punkt zwischen a und c so, daß G stromlos ist; dieser sei d′. Der Widerstand in a d′ betrage W′ Ohm, damit ist X = W′ . E10000. Dividiert man diese Gleichung durch die vorige, so ergibt sich X = En . W′Wn.
In Wirklichkeit wird G mit C verbunden und man variiert die Potentialdifferenz zwischen a und c. Zu diesem Zwecke ersetzt man den Widerstand a c durch einen Stöpselrheostaten und ändert diesen so lange, bis durch G kein Strom fließt. Selbstverständlich müssen jetzt die vorigen Gleichungen etwas umgeändert werden.
Zwischen den Punkten a und c muß ein großer Widerstand liegen, damit es ausgeschlossen ist, daß das Normalelement einen stärkeren Strom abgibt. Solche Elemente dürfen nämlich nur mit ganz schwachem Strome (etwa 0,0001 Amp.) beansprucht werden. Dadurch, daß man auch für W einen Widerstand von mehreren tausend Ohm wählt, erreicht man, daß der Spannungsabfall in a c der zu messenden elektrom. Kraft nahe kommt und daß, bevor die elektrom. Kraft En kompensiert ist, nur ein ganz schwacher Strom in das Element gelangen kann.
[129] Von dem Spannungsverluste in dem Netze wird abgesehen.
[130] Auch ist die Klemmenspannung von der Stromdichte abhängig. Diese Änderung wird im Folgenden der Einfachheit halber nicht berücksichtigt.
[131] In Wirklichkeit ist die Zahl etwas größer, da der Spannungsverlust in der Leitung gedeckt werden muß.
[132] In der schematischen Figur ist angenommen, daß die beiden Zellenschalter getrennte Apparate sind, so daß für jede Schaltzelle zwei Verbindungsleitungen nötig sind. In Wirklichkeit werden die beiden Zellenschalter zu einem Apparate vereinigt; sie haben gemeinsame Kontaktstücke, auf denen die beiden Hebel schleifen. Man nennt einen solchen Apparat Doppelzellenschalter.
[133] Ist die Maschine abgeschaltet, so wird durch das Voltmeter bei der gezeichneten Stellung der Hebel die Spannung der an der Stromlieferung beteiligten Elemente gemessen.
[134] Das von Peukert (E. T. Z. 1907, S. 705) angegebene Verfahren dürfte nur in vereinzelten Fällen anwendbar sein.
[135] Mit der Frage, in welchem Umfange die Dynamo an den Belastungsschwankungen beteiligt ist, hat sich Brandt beschäftigt. Siehe E. T. Z. 1899, S. 730.
[136] Nach Brandt (l. c.) ist die Pufferwirkung am günstigsten, wenn die Zellenspannung 2,07 Volt beträgt.
[137] E. T. Z. 1906, S. 314.
[138] E. T. Z. 1908, S. 89 u. S. 943, ebendaselbst 1910, S. 272.
[139] Bei diesem System werden die einzelnen Sprechstellen vom Vermittlungsamte aus über die Anschlußleitungen mit Strom versorgt.
[140] Näheres siehe E. T. Z. 1904, S. 838.
[141] E. T. Z. 1899 S. 632.
Otto Wigand, Verlagsbuchhandlung m.b.H., Leipzig
RITTERS
GEOGRAPHISCH-
STATISTISCHES
LEXIKON
über die Erdteile, Länder, Meere, Häfen, Seen,
:: :: Flüsse, Inseln, Gebirge, Staaten, Städte, :: ::
Flecken, Dörfer, Bäder, Kanäle, Eisenbahnen,
:: :: :: Post- und Telegraphenämter u.s.w. :: :: ::
Ein Nachschlagewerk über jeden geographischen Namen
der Erde von irgendwelcher Bedeutung für den Weltverkehr
Neunte, revidierte Auflage 1910
Zwei Halbleder-Bände M. 50.—
Das hinsichtlich seiner Reichhaltigkeit und Genauigkeit nicht zu übertreffende Werk enthält in etwa 400 000 Artikeln auf 2700 Seiten alle wichtigen geographischen und statistischen Notizen, alle Postämter, Telegraphenämter, Land- und Seeverbindungswege, Gerichtsbehörden, Import, Export, Handelsstatistiken u.s.w. Es ist ein unentbehrliches Nachschlagewerk für jeden Geographen, Statistiker, Volkswirtschaftler und — last not least — für jeden Kaufmann.
| Eine wertvolle, unerläßliche Ergänzung | ||
| zu jedem Konversations-Lexikon |
Otto Wigand, Verlagsbuchhandlung m.b.H., Leipzig
Vom gleichen Verfasser erschien bei mir:
·DER ELEKTRISCHE STROM·
UND SEINE WICHTIGSTEN ANWENDUNGEN
GEMEINVERSTÄNDLICHE DARSTELLUNG VON
PROFESSOR DR. W. BERMBACH IN KÖLN
Dritte, umgearbeitete und stark vermehrte Auflage
38 Bogen mit 237 Abbildungen. Preis geheftet M. 7.—, gebunden M. 8.50
Inhalt: I. Arbeit und Energie. II. Magnetismus. III. Grundbegriffe der Elektrizitätslehre. IV. Das Ohmsche Gesetz, Anwendungen desselben. V. Stromverzweigungen, Serien- und Parallelschaltung der Stromabnehmer. VI. Stromarbeit, Watt, Stromwärme (Joulesche Wärme). VII. Wechselwirkungen zwischen Strömen und Magneten, Elektromagnetismus. VIII. Einwirkung zweier Ströme aufeinander, Elektrodynamik. IX. Induktionserscheinungen. X. Wechselströme. XI. Dynamomaschinen. XII. Elektromotoren. XIII. Transformatoren und Umformer. XIV. Grundbegriffe der Elektrochemie, Theorie der galvanischen Elemente und der Elektrolyse. XV. Anwendungen der Elektrochemie. XVI. Elektrizität in Gasen. XVII. Elektrische Schwingungen und elektromagnetische Wellen, Funkentelegraphie. XVIII. Elektromagnetische Telegraphie und Telephonie. XIX. Elektrische Kraftübertragung und elektrische Beleuchtung. XX. Thermoelektrizität. XXI. Elektrische Meßinstrumente. Anhang: Das absolute Maßsystem.
Verlag von R. Oldenbourg, München u. Berlin
Die Elektrotechnik. (Band II der „Illustrierten Technischen Wörterbücher in sechs Sprachen‟: Deutsch, Englisch, Französisch, Russisch, Italienisch, Spanisch.) Bearbeitet von Alfred Schlomann, Ingenieur. 2112 Seiten mit etwa 4000 Abbild. und zahlreichen Formeln, etwa 15 000 Worte in jeder der 6 Sprachen enthaltend. In Lwd. gebd. Preis M. 25.—.
Deutscher Kalender für Elektrotechniker. Begründet von F. Uppenborn. In neuer Bearbeitung herausgegeben von G. Dettmar, Generalsekretär des Verbandes Deutscher Elektrotechniker. Zwei Teile, wovon der erste Teil in Brieftaschenform (Leder) gebd. Erscheint alljährl. Preis M. 5.—.
Lehrgang der Schaltungsschemata elektrischer
Starkstromanlagen.Unter Mitwirkung seines Assistenten
Diplom-Ingenieur W. Fels herausgegeben
von Professor Dr. J. Teichmüller, Karlsruhe.
| I. | Teil: Schaltungsschemata für Gleichstromanlagen. 25 lithographische Tafeln und 103 Seiten Text. In Leinwand gebunden Preis M. 10.—. |
| II. | Teil: Schaltungsschemata für Wechselstromanlagen. 28 lithographische Tafeln mit 170 Seiten Text. In Leinwand gebunden Preis M. 12.—. |
Ausführliche Prospekte über obige sowie andere neue elektro-
:: :: :: technische Werke stehen kostenlos zur Verfügung. :: :: ::
Druck: Otto Wigand m. b. H., Leipzig.
Die Inkonsistenzen im Originalwerk sind beibehalten worden.
Abhängig von der benutzten Hard- und Software sind möglicherweise nicht alle Elemente des Textes richtig zu sehen.
Seite 37, 2), 3) usw.: die Nummer 1) fehlt im Originalwerk.
Seite 165, Fußnote [128]: auf der Seite 165 des Originalwerkes gibt es
keine Fußnotenzeichen; das Zeichen fehlt deshalb auch in diesem Text.
Durchgeführte Änderungen und Verbesserungen
Klare Fehler in Rechtschreibung, Interpunktion usw. sind
stillschweigend korrigiert worden.
Einige Tabellen sind umgeordnet worden.
In chemische Formel, Prozente, usw. wurden eventuelle Leerzeichen
entfernt.
| Seite | Original | Korrigiert |
|---|---|---|
| Seite 5 | van’t Hoff | van ’t Hoff |
| Seite 12, Gleichung (4) | HSO′4 | HSO4′ |
| Seite 32 | 2OH′ + 2⊕ = 2OH | 2OH′ + 20⊕ = 2OH |
| Seite 55 | Umkehrung von 10 | Umkehrung von I, 10 |
| Umkehrung von 9 | Umkehrung von I, 9 | |
| Seite 83 | voraufgegangenen | vorausgegangenen |
| Seite 119 | heransgespült | herausgespült |
| Seite 141 | Beaumé | Baumé |
| Seite 154 | Deutsche Edison-Akkumulatoren-Compagny | Deutsche Edison-Akkumulatoren-Company |
| Seite 186 | a x G d | a X G d |